微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某无色溶液中滴入石蕊试液显红色,该溶液中可以大量共存的是
A.Na+、Cl-、Mg2+、ClO-
B.Fe2+、NH4+、Cl-、NO3-
C.Na+、HCO3-、AlO2-、K+
D.Na+、Ba2+、Cl-、NO3-
参考答案:D
本题解析:分析:无色溶液中滴入石蕊试液显红色,溶液显酸性,离子之间不能结合生成水、气体、沉淀、弱电解质,不能发生氧化还原反应,则大量共存,并结合离子的颜色来解答.
解答:无色溶液中滴入石蕊试液显红色,溶液显酸性,
A.H+、ClO-结合生成弱电解质,则不能大量共存,故A错误;
B.Fe2+、H+、NO3-发生氧化还原反应,则不能共存,故B错误;
C.AlO2-促进了HCO3-的电离,则不能共存,故C错误;
D.该组离子之间不反应,则能大量共存,故D正确;
故选D.
点评:本题考查离子的共存,明确习题中的信息及离子之间的反应即可解答,选项C为解答的难点,题目难度不大.
本题难度:一般
2、选择题 下列化学反应属于氧化还原反应的是
A.CaO+H2O=Ca(OH)2
B.CaCO3=CaO+CO2↑
C.CaCO3+HCl=CaCl2+H2O+CO2↑
D.Zn+H2SO4=ZnSO4+H2↑
参考答案:D
本题解析:分析:氧化还原反应的特征为有化合价的升降,反应属于氧化还原反应的变化,肯定存在化合价的变化,以此解答该题.
解答:A.该反应中各元素的化合价都不变化,所以不是氧化还原反应,但属于化合反应,故A错误;
B.该反应中各元素的化合价都不变化,所以不是氧化还原反应,但属于分解反应,故B错误;
C.该反应中各元素的化合价都不变化,所以不是氧化还原反应,但属于复分解反应,故C错误;
D.该反应中锌和S的化合价发生变化,所以该反应一定是氧化还原反应,故D正确;
故选D.
点评:本题考查氧化还原反应,题目难度不大,注意从化合价的角度分析.
本题难度:简单
3、选择题 将1L?1.00mol/L?的Na2CO3溶液逐滴加入到1L?1.25mol/L的盐酸中;再做相反操作:将1L?1.25mol/L的盐酸逐滴加入1L?1.00mol/L?的Na2CO3溶液中,两次操作产生的气体体积之比是(同温同压下?)
A.2:5
B.5:2
C.1:1
D.2:1
参考答案:B
本题解析:分析:向盐酸溶液中滴加Na2CO3溶液,盐酸足量,发生反应Na2CO3+2HCl=2NaCl+CO2↑+H2O;但向Na2CO3溶液中滴加稀盐酸,盐酸不足,首先发生Na2CO3+HCl=NaHCO3+NaCl,然后发生NaHCO3+HCl=NaCl+CO2↑+H2O,据此根据方程式进行过量计算.
解答:1L?1.00mol/L?的Na2CO3溶液中n(Na2CO3)=1L×1mol/L=1mol,
1L?1.25mol/L的盐酸中n(HCl)=1L×1.25mol/L=1.25mol,
把Na2CO3溶液逐滴加到盐酸中,开始时盐酸过量,发生反应Na2CO3+2HCl=2NaCl+H2O+CO2↑,故:
? Na2CO3 +2HCl=2NaCl+H2O+CO2↑
? 1mol? 2mol?
故HCl不足,由方程式可知,生成二氧化碳物质的量为1.25mol× =0.625mol,
=0.625mol,
向Na2CO3溶液逐滴滴入盐酸,首先发生:Na2CO3+HCl=NaHCO3+NaCl,则:
Na2CO3+HCl=NaHCO3+NaCl
1mol? 1mol?
1molNa2CO3消耗1molHCl,剩余0.25molHCl,故生成1molNaHCO3
然后发生:NaHCO3+HCl=NaCl+CO2↑+H2O;
?0.25mol 0.25mol
故NaHCO3有剩余,生成二氧化碳0.25mol,
故两次操作产生的气体体积之比是0.625mol:0.25mol=5:2,
故选B.
点评:本题考查混合物的有关计算、Na2CO3与盐酸的反应,难度中等,清楚滴加顺序不同所发生的反应是关键.
本题难度:一般
4、选择题 10 mL某种气态烃,在50 mL氧气里充分燃烧,得到液态水和体积为35 mL的混合气体(所有气体体积都是在同温同压下测定的),则该气态烃可能是
A.甲烷
B.乙烷
C.丙烷
D.丁烯
参考答案:B
本题解析:根据题意,氧气充足,CxHy+(x+y/4)→xCO2+y/2H2O,体积减少25 mL,减少体积与烃的体积成正比关系,1∶(1+x+y/4-x)=10∶25,得y=6.
本题难度:简单
5、选择题 在标准状况下,将NO、NO2、O2三种气体按一定比例充满一固定容积的容器,并将该容器倒置在水槽中,充分反应后,容器中无气体剩余,所得溶液的浓度为Mmol/L.则M的取值范围是
A.0<M<
B.<M<
C.<M<
D.<M<
参考答案:D
本题解析:分析:将NO、NO2、O2三种气体按一定比例充满一固定容积的容器,并将该容器倒置在水槽中,充分反应后,容器中无气体剩余,
可能发生:4NO2+O2+2H2O=4HNO3或4NO+3O2+2H2O=4HNO3,所得溶液为HNO3溶液,利用端值法解答.
解答:若混合气体是NO2和O2,且体积比为4:1,因为发生反应:4NO2+O2+2H2O=4HNO3,生成硝酸的物质的量是溶于水的气体物质的量的 ,所得溶液的体积等于溶于水的气体体积,所以所得溶液的物质的量浓度为
,所得溶液的体积等于溶于水的气体体积,所以所得溶液的物质的量浓度为 mol/L=
mol/L=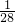 mol/L;
mol/L;
若混合气体是NO和O2,且二者体积比为3:4,因为发生反应:4NO+3O2+2H2O=4HNO3,生成硝酸的物质的量是溶于水的气体物质的量的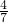 ,所得溶液体积等于溶于水的气体体积,所得溶液的物质的量浓度为
,所得溶液体积等于溶于水的气体体积,所得溶液的物质的量浓度为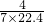 moL/L=
moL/L= mol/L,
mol/L,
因是三种物质的混合物,应介于二者之间,
故选D.
点评:本题是有关NO2、NO和O2混合气体溶于水的计算问题,要解决这类问题应注意利用端值法结合反应的化学方程式计算,题目难度较大.
本题难度:简单