微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
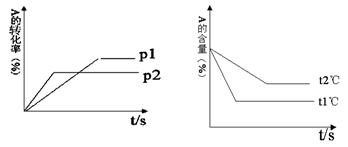
(1)压强P1比P2 (填大或小);
(2)(a+b)比(c +d) (填大或小);
(3)温度t1℃比t2℃ (填高或低);
(4)正反应为 (填吸热或放热)反应。
2、选择题 在2L恒容密闭容器中充入2 mol X和lmol Y发生反应:2X(g)+Y(g) 3Z(g)△H<0, 反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g)△H<0, 反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
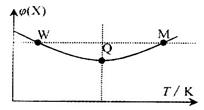
A.升高温度,平衡常数增大
B.W点X的正反应速率等于M点X的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
3、实验题 某探究小组用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速度的因素。
实验药品:2.0 mol/L盐酸、4.0 mol/L盐酸、2.0 mol/L硫酸、4.0 mol/L硫酸、相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0 mL,金属用量均为9.0 g。
Ⅰ.甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
反应进程
(分钟)
| 1
| 2
| 5
| 15
| 20
|
4.0 mol/L
盐酸
| 少量气泡
| 较多气泡
| 大量气泡
| 反应剧烈
| 铝片耗尽
|
2.0 mol/L
硫酸
| 无明显现象
| 极少量
气泡
| 少量气泡
|
4.0 mol/L
硫酸
| 无明显现象
| 少量气泡
| 有比较连续的气泡
|
?
请回答下列问题:
(1)写出铝与盐酸反应的离子方程式:?。
(2)反应在1~15min内,铝与盐酸的反应速率逐渐增大,其原因是?。
(3)根据以上探究“铝与稀盐酸和稀硫酸的反应速率存在差异的原因”,你能对原因作出哪些假设或猜想:?(写出一种即可)。
Ⅱ.乙同学设计了如下影响反应速率因素的实验。请你根据实验目的帮助该同学完成以下实验设计表:
实验目的
| 实验
编号
| 温度
/℃
| 金属铝的
形态
| 盐酸浓度
/mol·L-1
|
1.实验①和②探究盐酸浓度对该反应速率的影响;
2.实验①和③探究温度对该反应速率的影响;
3.实验①和④探究金属规格(铝片、 铝粉)对该反应速率的影响
| ①
| 25
| 铝片
| 4.0
|
②
| ?
| ?
| ?
|
③
| ?
| ?
| ?
|
④
| ?
| ?
| ?
|
?
4、填空题 用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断________段化学反应速率最快,_______段收集的氢气最多。这段反应速率最快的原因是______________________________________
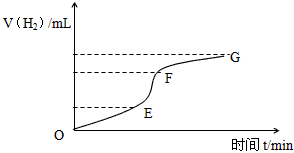
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是_____________________
A.蒸馏水 B.氯化钠固体 C.氯化钠溶液 D.浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(至少回答一种)
______________________________________
5、选择题 一定量的盐酸跟足量镁粉反应时,为了减缓化学反应速率,且不影响生成的H2的总量,可向盐酸中加入适量的
[? ]
A.NaOH固体
B.H2O
C.CH3COONa固体
D.醋酸