微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关化学平衡移动叙述,正确的是( )
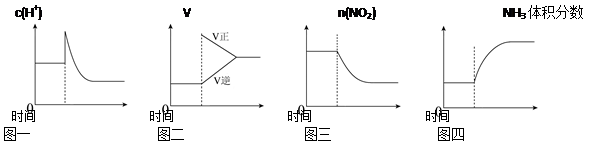
A.可逆反应:Cr2O742-+H2O 2CrO42-+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硝酸,溶液变橙色,氢离子浓度随时间变化曲线如上图一
2CrO42-+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硝酸,溶液变橙色,氢离子浓度随时间变化曲线如上图一
B.可逆反应Co(H2O) 62++ (粉红色)+4Cl- CoCl42-+ (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如上图二
CoCl42-+ (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如上图二
C.可逆反应:2NO2 N2O4达平衡状态呈红棕色,加压(缩小体积)红棕色变深,NO2物质的量随时间变化曲线如上图三
N2O4达平衡状态呈红棕色,加压(缩小体积)红棕色变深,NO2物质的量随时间变化曲线如上图三
D.可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如上图四
2NH3(g) ΔH<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如上图四
参考答案:C
本题解析:A.当可逆反应达到平衡后,滴加少量的浓硝酸,使溶液中的C(H+)浓度增大,增大生成物的浓度,化学平衡向逆反应方向移动,氢离子的浓度略有减少,但总的来说与滴加前比浓度增大。图像错误。B. .当可逆反应达到平衡后,升高温度化学平衡向吸热反应方向移动。。无论是正反应速率还是逆反应速率都与升高温度前比都增大。图像错误。C. 当可逆反应达到平衡后, 加压(缩小体积),反应混合物的浓度都增大,但反应物的浓度增大的多,所以平衡向正反应方向移动,使NO2物质的量减少。图像符合实际。正确。D. 由于该反应的正反应是放热反应。所以当可逆反应达到平衡后升高温度,化学平衡向逆反应方向移动,达到新的平衡后NH3体积分数减小。错误。
本题难度:简单
2、填空题 在容积为2 L的容器中,放入0.4 mol A和0.6 mol B,在一定温度下,压强为p,放入催化剂(催化剂体积忽略不计)发生反应,2A(g)+3B(g) xC(g)+2D(g),在a min后,容器中c(A)="0.1" mol·L-1,此时,若温度与压强均未改变,则v(B)=_______________________,x=______________;若温度不变,压强为
xC(g)+2D(g),在a min后,容器中c(A)="0.1" mol·L-1,此时,若温度与压强均未改变,则v(B)=_______________________,x=______________;若温度不变,压强为 p,则v(C)="____________" mol·L-1·min-1,x=
p,则v(C)="____________" mol·L-1·min-1,x=
_____________________。
参考答案: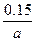 ?mol·L-1·min-1? 3?
?mol·L-1·min-1? 3?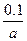 ?2
?2
本题解析:发生反应后压强没有改变,说明为等体积反应,2+3=x+2,x=3,v(B)= v(A)=
v(A)=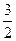 ×
×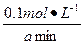 =
=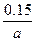 ?mol·L-1·min-1。温度不变,压强变为原来的
?mol·L-1·min-1。温度不变,压强变为原来的 ,说明气体的物质的量减少了
,说明气体的物质的量减少了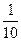 ,即0.1 mol,而A减少了0.2 mol,
,即0.1 mol,而A减少了0.2 mol,
2A+3B="===xC+2D?" Δn
2? 3-x
0.2 mol? 0.1 mol
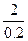 =
=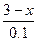 ? x=2
? x=2
v(C)=v(A)=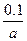 ?mol·L-1·min-1
?mol·L-1·min-1
本题难度:简单
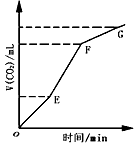
3、选择题 用纯净的CaCO3与稀HCl反应制CO2,实验过程记录如图所示。根据分析、判断,正确的是
[? ]
A.OE段表示反应速率最快
B.EF段表示反应速率最快,收集的CO2最多
C.FG段表示收集的CO2最多
D.OG段表示随着时间的推移,反应速率逐渐增快
参考答案:B
本题解析:
本题难度:一般
4、选择题 在Zn+H2SO4 = ZnSO4+H2?反应中,2分钟内硫酸浓度由l.5 mol·L-1降至1.1 mol·L-1,则2分钟内用硫酸表示的平均反应速率为?(?)
A.0.1mol·L-1·min-1
B.0.2mo1·L-1·min-1
C.0.3mol·L-1·min-1
D.0.4mo1·L-1·min-1
参考答案:B
本题解析:v(H2SO4)= 。答案选B。
。答案选B。
点评:本题非常基础简单,只要根据公式计算即可。
本题难度:一般
5、选择题 对于实验室制O2的反应:2KClO3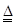 2KCl+3O2↑,下列条件的改变,可加快反应速率的是
2KCl+3O2↑,下列条件的改变,可加快反应速率的是
A.加热
B.增大KClO3固体的量
C.使用MnO2做催化剂
D.降温