微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于物质性质的比较,不正确的是( )
A.酸性强弱:HI04>HBr04>HCl04
B.原子半径大小:Mg>P>N
C.碱性强弱:KOH>NaOH>LiOH
D.金属性强弱:Na>Mg>Al
参考答案:A.非金属性:Cl>Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故A错误;
B.同主族元素从上到下,原子半径逐渐增大,同周期元素从左到右,原子半径逐渐减小,则原子半径Mg>P>N,故B正确;
C.金属性:K>Na>Li,元素的金属性越强,对应的最高价氧化物的碱性越强,故C正确;
D.同周期元素从左到右,金属性逐渐减弱,则金属性强弱:Na>Mg>Al,故D正确.
故选A.
本题解析:
本题难度:简单
2、选择题 下列各组为两种元素的原子序数,其中不能反应生成AB3型化合物的是:
A.13和17
B.16和8
C.9和3
D.15和17
参考答案:C
本题解析:A可以生成AlCl3,B可以生成SO2,C可以生成LiF,D可以生成PCl3,所以答案是C。
本题难度:困难
3、选择题 下列叙述正确的是?
[? ]
A.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物;硫磺燃烧生成SO2
B.Li2O与水反应,红热的Fe与水蒸气反应均能生成碱;碱金属即为IA族元素
C.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳;浓硝酸、浓硫酸能使铁铝钝化
D.元素周期律是元素的性质随元素相对原子质量的递增发生周期性递变的规律;俄国化学家门捷列夫的元素周期表是按元素周期律编排的
参考答案:A
本题解析:
本题难度:简单
4、选择题 根据元素周期表和元素周期律分析下列说法,其中不正确的是
[? ]
A.硒化氢比硫化氢稳定
B.铍原子失电子能力比镁弱
C.砹的氢化物不如氯化氢稳定
D.氢氧化钾比氢氧化钠的碱性强
参考答案:A
本题解析:
本题难度:一般
5、简答题 下列为元素周期表的一部分,表中阿拉伯数字(1、2…)是原周期表中行或列的序号.请参照元素A~I在表中的位置,回答下列问题.
| ?纵行 | ?1 | ? | ?18
?横行
?1
?A
?2
?13
?14
?15
?16
?17
?
?2
?
?
?
?B
?C
?D
?E
?
?3
?F
?
?G
?H
?
?
?I
?
|
(1)B、C两元素中非金属性较强的是______(写出元素名称),请设计一个简单的实验证明这一结论______.
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
______
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:______.
(4)I元素在周期表里的位置在第______周期、第______族.
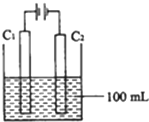
实验室中采用如图所示装置模拟工业上同时制取元素A和I的单质过程:
①写出电极C1上发生反应的电极反应式______.
②当电极上产生112mL(标准状况)元素I单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=______.(KW=1.00×10-14)
参考答案:根据元素周期表知,A是H元素,B是C元素,C是N元素,D是O元素,E是F元素,F是Na元素,G是Al元素,H是Si元素,I是Cl元素;
(1)B、C两元素中非金属性较强的是氮元素,非金属的非金属性越强,其最高价氧化物的水化物酸性越强,用碳酸钠或碳酸氢钠与稀硝酸反应,观察是否有有无色无味的气体产生,如果能产生无色无味的气体,则说明氮元素的非金属性大于碳元素,
故答案为:氮;取碳酸钠或碳酸氢钠溶液置于试管中,向其中滴加稀硝酸,观察是否有无色无味的气体产生,HNO3+NaHCO3═NaNO3+H2O+CO2↑,或2HNO3+Na2CO3═2NaNO3+H2O+CO2↑;
(2)氧化铝是两性氧化物,氧化铝和氢氧化钠反应生成偏铝酸钠和水,离子反应方程式为:Al2O3+2OH-═2AlO2-+H2O,故答案为:Al2O3+2OH-═2AlO2-+H2O;
(3)氧元素和氢元素能形成原子个数比为1:1和1:2的两种共价化合物H2O2和H2O,氧元素元素还能钠元素构成离子个数比为1:1和1:2的两种离子化合物Na2O2和Na2O,过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为:2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(4)氯元素的原子结构示意图为:
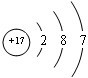
,所以氯元素处于第三周期,第VIIA族,故答案为:三;VIIA;
①电解时阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
②设氢氧根离子浓度为xmol/L,电池反应式为:
2Cl-+2H2O=H2↑+Cl2↑+2OH-
?22.4L?2mol?
? 0.112L?0.1xmol
x=0.112L×2mol22.4L×0.1mol=0.1,溶液中c(H+)=10-140.1?mol/L=10-13 mol/L,所以pH=13,
故答案为:13.
本题解析:
本题难度:一般