微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在实验室里,要想使AlCl3溶液中的Al3+全部沉淀出来,应选用下列试剂中的
A.石灰水
B.氢氧化钠
C.硫酸
D.氨水
参考答案:D
本题解析:Al3+全部沉淀可以和碱反应,也可以和能水解显碱性的盐反应;Al(OH)3是两性氢氧化物能溶于强酸强碱,Al3+离子全部沉淀需要所加的试剂过量,所以全部沉淀Al3+最好不用强碱用弱碱。
氢氧化钠溶液、石灰水(氢氧化钙溶液)都是强碱溶液,沉淀Al3+时生成的氢氧化铝能溶解在过量的强碱溶液中,所以Al3+不能全部沉淀出来,故A、B不符合;稀硫酸不与氯化铝反应,故C不符合;氨水是弱碱溶液,可以全部沉淀Al3+,因为AI(OH)3不溶于弱碱溶液,故D正确。
故选D。
点评:本题考查了铝盐、氢氧化铝的性质应用,重点考查氢氧化铝的实验室制备。
本题难度:简单
2、选择题 下列有关金属及其化合物的说法错误的是
A.铁与水蒸气在高温条件下反应生成四氧化三铁和氢气
B.稀硫酸中加入铜粉不反应,再加入硝酸钠仍不反应
C.AlCl3、FeCl2、CuCl2均可通过化合反应制得
D.饱和碳酸钠溶液中通人足量二氧化碳,溶液变浑浊
参考答案:B
本题解析:A、铁与水蒸气在高温条件下反应生成四氧化三铁和氢气,正确;B、稀硫酸中加入铜粉不反应,再加入硝酸钠发生的反应为:3Cu + 2NO3- + 8H+ ="===" 3Cu2+ + 2NO↑+ 4H2O,错误;C、AlCl3、CuCl2均可通过单质与氯气化合制得,FeCl2可通过铁与氯化铁溶液化合制得,正确;D、饱和碳酸钠溶液中通入足量二氧化碳,生成碳酸氢钠,碳酸氢钠的溶解度小于碳酸钠,溶液变浑浊,正确。
本题难度:一般
3、选择题 将两种金属混合而成的粉末30 g,与足量的盐酸反应,产生氢气22.4 L,该混合物可能是(?)
A.镁和铜
B.钠和锌
C.铁和钙
D.铝和镁
参考答案:A
本题解析:由极限法分析:若全部为选项中某金属产生氢气22.4 L所消耗的质量分别为:镁24 g、钠46 g、锌65 g、铁56 g、钙40 g、铝18 g,铜不反应可认为需要无穷大的质量,混合物30 g就可产生同样量的气体,一定含有镁,答案为A。
本题难度:简单
4、选择题 向amL浓度为0.25 mol·L-1的AlCl3溶液中加入金属钾,完全反应后,恰好只生成KCl和KAlO2的溶液,则加入钾的物质的量是(? )
A.2.5a×10-4mol
B.5a×10-4 mol
C.7.5a×10-4mol
D.a×10-3 mol
参考答案:D
本题解析:由
4KOH +AlCl3====KAlO2+3KCl+2H2O
4? 1
a×10-3 mola×0.25×10-3mol
知K为a×10-3 mol。
本题难度:一般
5、实验题 合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
〖实验方案一〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。实验中发生反应的化学方程式是
〖实验步骤〗
(1)称取5.4 g铝镁合金粉末样品,溶于VmL 2.0 mol/LNaOH溶液中,充分反应。则NaOH溶液的体积V ≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”、“偏低”或“无影响”)。
〖实验方案二〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积。
〖问题讨论〗
(3)同学们拟选用下列实验装置完成实验:
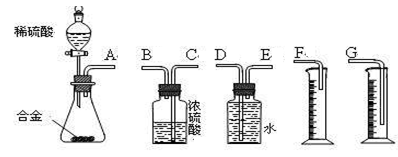
①你认为最简易的装置其连接顺序是(填接口字母,可不填满):
A接( )( )接( )( )接( )
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因。 ?。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平,读取量筒中水的体积
参考答案:[方案一]2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(1)97 mL?(2)偏高
[方案二](3)① EDG?
②锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大
③ ACD
本题解析:[方案一]铝可以与氢氧化钠反应,镁不与氢氧化钠反应,所以将铝镁合金与足量NaOH溶液反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;(1)称取5.4 g铝镁合金粉末样品,溶于VmL 2.0 mol/LNaOH溶液中,充分反应,由于含镁3%~5%,要确保NaOH过量,所以镁的含量要假设为3%,5.4 g铝镁合金含有的铝最大为5.4/27×0.97=0.194mol,所以需要的NaOH溶液的体积为V=0.194/2.0×1000 mL="97" mL,所以NaOH溶液的体积
V ≥97 mL;若未洗涤固体,则称得的镁的质量比实际的大,所以测得镁的质量分数将偏高;(3)①由于氢气的密度小于空气的密度,可以采用向下排空气的方法,若要收集教纯净的氢气,可以采用排水法,所以该实验的连接顺序为A接EDG?;②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,因为锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大,所以一会儿后稀硫酸不能顺利滴入锥形瓶;③实验结束时,要等待实验装置冷却后再读数,此时上下移动量筒G,使其中液面与广口瓶中液面相平,再让视线与凹液面的最低点水平,读取量筒中水的体积,故本题的答案为ACD。
点评:本题考查了镁铝合金,利用两种金属的性质设计实验,该题综合性强,有利于考查学生自身的综合能力,本题有一定的难度。
本题难度:一般