| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《离子方程式的书写及正误判断》高频考点强化练习(2017年最新版)(六)
参考答案:B 本题解析:Cu(OH)2+2H+=Cu2++2H2O表示氢氧化铜与强酸的反应,故A可以表示多个反应,A错误; Fe2++SO42-+Ba2++2OH-=Fe(OH)2↓+BaSO4↓,只表示硫酸亚铁与氢氧化钡的反应,故B正确;Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,不但表示硫酸与氢氧化钡的反应,还表示向NaHSO4溶液滴加Ba(OH)2溶液至溶液呈中性的反应,故C错误;2H+ + Fe(OH)2=Fe2++ 2H2O表示强酸与氢氧化亚铁的反应,故D错误,答案选B。 本题难度:一般 2、填空题 (6分) 向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题: 参考答案:(1)Ba2++2OH-+SO42-+2H+===BaSO4↓+2H2O (2)A (3) C 。 本题解析:(1) Ba(OH)2与稀硫酸反应的离子方程式是Ba2++2OH-+SO42-+2H+===BaSO4↓+2H2O;(2)A.酸式盐与碱反应时应该以不足量的物质为标准,离子方程式与硫酸和氢氧化钡反应的离子方程式相同,正确;B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO 本题难度:一般 3、选择题 (原创)下列离子方程式错误的是 |
参考答案:A
本题解析:A、NH4HCO3溶于过量的NaOH溶液,NH4+也与OH?反应,错误;B、向KI溶液中加H2SO4溶液后振摇,在酸性条件下,I?被O2氧化,离子方程式为:4H+ + 4I-+ O2 = 2I2 + 2H2O,正确;C、酸性高锰酸钾中加入草酸,MnO4?能把H2C2O4氧化为CO2,离子方程式为:2MnO4- + 5H2C2O4 + 6 H+ = 2Mn2+ + 10CO2↑ +8H2O,正确;D、CO2、H2O与硅酸盐反应生成H2SiO3,可证明H2CO3的酸性大于H2SiO3,则C的非金属性强于Si,离子方程式为:SiO32-+ CO2+ H2O = H2SiO3↓+ CO32-,正确。
考点:本题考查离子方程式的书写。
本题难度:一般
4、填空题 某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的一种或几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示。回答下列问题: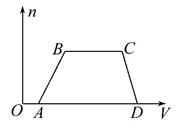
(1)溶液中一定含有的溶质是 ,一定不含有的溶质是 (填化学式)。
(2)溶液中可能含有的溶质是 (填名称),判断该物质是否存在的实验方法是 ,现象是 。
(3)分别写出AB段、BC段发生反应的离子方程式:
①AB段为 ;
②BC段为 。
参考答案:(1)HCl、AlCl3、NH4Cl MgCl2、Na2CO3
(2)氯化钾 焰色反应 透过蓝色钴玻璃观察焰色反应为紫色
(3)①Al3++3OH-====Al(OH)3↓
②N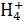 +OH-====NH3·H2O
+OH-====NH3·H2O
本题解析:首先分析图像中的拐点、斜线及水平线所表示的化学意义。OA段是NaOH溶液中和HCl;加入过量NaOH溶液,沉淀全部溶解,说明无MgCl2,所以沉淀只有Al(OH)3;BC段是NaOH溶液与NH4Cl反应,故原溶液中一定含有HCl、AlCl3、NH4Cl,一定无MgCl2;又因为AlCl3、HCl与Na2CO3不能大量共存,所以一定无Na2CO3;可能含有KCl,可用焰色反应进行确定。
考点:铝的氧化物与氢氧化物 从铝土矿中提取铝
本题难度:一般
5、选择题 能正确表示下列反应的离子方程式为 ( )
A.少量SO2通入苯酚钠溶液中(酸性:H2SO3>HSO3->苯酚):SO2+H2O+C6H5O-=C6H5OH+HSO3
参考答案:
本题解析:
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《与量有关的.. | |