微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)A、B、C、D、E、F、G为由七种短周期元素构成的粒子,它们都有10个电子,其结构特点如下表:
其中,B的离子半径大于E的离子半径;D是常温常压下能使湿润红色石蕊试纸变蓝色的气体;C常用作F的检验(加热)。请填写下列空白:
(1)A粒子的结构示意图 ,G的化学式是 。
(2)比较BC和EC2的碱性强弱BC EC2(填< 、> 、=" " )。
(3)F与C反应生成D的离子方程式 。
参考答案:
(1)H2O (2)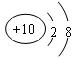 (3)> (4)NH4+ +OH
(3)> (4)NH4+ +OH
本题解析:
本题难度:一般
2、选择题 (4分)有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO3-、SO42-(每种离子只能用一次)
现将溶液两两混合,记录现象如下:
A+B→白色沉淀;B+ D→白色沉淀;C+D→蓝色沉淀
则(1)A、B、C、D的化学式分别是_________、__________、___________、_________。
(2)分别写出下列反应的离子方程式
A+B→
B+ D→
C+D→
参考答案:A、AgNO3 B、MgCl2 C、CuSO4 D、NaOH
Ag++Cl-=AgCl↓ Mg2++2OH-=Mg(OH)2↓ Cu2++2OH-=Cu(OH)2↓
本题解析:略
本题难度:一般
3、填空题 (8分)取20mL硫酸和盐酸的混合液体,加入过量的氯化钡溶液,产生4.66g白色沉淀,然后继续向溶液中加入ag(足量)铁粉,产生的气体的体积为896mL(标准状况下)。
(1)写出上述过程中发生的离子方程式_______________________________________
________________________________________________________________________。
(2)计算原混合液体中,硫酸物质的量浓度是_________________mol/L,盐酸物质的量浓度是_____________________mol/L(写出计算过程)。
参考答案:(1)Ba2++SO42-=BaSO4↓(2分) Fe+2H+=Fe2++H2↑(2分)(2)1 mol/L 2 mol/L(2分)
本题解析:(1)硫酸和盐酸的混合液体,加入过量的氯化钡溶液发生的反应离子方程式为:Ba2++SO42-=BaSO4↓,加入铁粉后,铁粉与溶液中的H+反应,离子方程式为:Fe+2H+=Fe2++H2↑(2)根据Ba2++SO42-=BaSO4↓,生成的白色沉淀为BaSO4,其物质的量为:4.66g÷233g/mol=0.02mol,那么SO42-的物质的量为0.02mol,则硫酸的物质的量也为0.02mol,硫酸的物质的量浓度为:0.02mol÷0.02L="1" mol/L。加入铁粉产生的气体是氢气,物质的量为:0.896L÷22.4L/mol=0.04mol,需要的H+的物质的量为0.08mol,硫酸的物质的量为0.02mol,所以硫酸提供的H+物质的量为0.04mol,则盐酸提供的H+物质的量为:0.08mol-0.04mol=0.04mol,盐酸的物质的量浓度为:0.04mol÷0.02L="2" mol/L
考点:离子方程式的书写、物质的量的计算。
本题难度:一般
4、填空题 根据要求写出方程式。
① NaCl溶液与AgNO3溶液反应 (写出离子方程式)
② K2SO4 (写出电离方程式)
③ NaHCO3 (写出电离方程式)
参考答案:略
本题解析:略
本题难度:一般
5、选择题 下列离子方程式书写正确的是
A.金属钠溶于水:2Na+2H2O =2Na++2OH—+H2↑
B.氯化铝溶液与足量氨水反应:Al3+ + 4OH- =AlO2- +2H2O
C.硫酸铜溶液与氢氧化钡溶液反应:Cu2+ +2OH?- =Cu(OH)2↓
D.铁与稀硫酸反应:2Fe +6H+ =2Fe3++3H2↑
参考答案:A
本题解析:A正确。
B错误,氨水不应该写成离子形式,并且最后生成的氢氧化铝是沉淀不溶于弱碱。
C错误,少写了硫酸根离子与钡离子反应生成沉淀。
D错误,铁在稀硫酸中不会被氧化成+3价。
所以正确选项为A。
本题难度:简单