微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)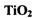 在工业生产和日常生活中有重要用途。 I.工业上用钛矿石(
在工业生产和日常生活中有重要用途。 I.工业上用钛矿石( ,含
,含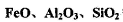 等杂质)经过下述反应制得:
等杂质)经过下述反应制得:

其中,步骤②发生的反应为: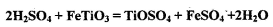
(1)净化钛矿石时,是否需要除去杂质FeO? ______ (填“需要”或“不需要”)。
(2)?净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式: __________________
II. TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Th将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为__________________
“方法二”是先将TiO2与 Cl2、C反应得到TiCl4,再用镁还原得到TL因下述反应难于发生: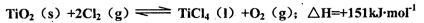
所以不能直接由Ti02和Cl2反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(4)?己知: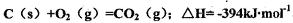
请写出 与Cl2、C反应制取TiO4的热化学方程式:____________
与Cl2、C反应制取TiO4的热化学方程式:____________
(5)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因________________________________________________
参考答案:(14分)(4)、(5)每空3分,其余每空2分?(1)不需要
本题解析:略
本题难度:困难
2、选择题 两只串联的电解池,左池放CuSO4溶液,右池放一定量的某硝酸盐稀溶液,电解时,当左池析出1.6g铜时,右池析出0.45g固体,则右池中的溶质为( )
A.AgNO3
B.NaNO3
C.Mg(NO3)2
D.Al(NO3)3
参考答案:左池盛有足量的CuSO4溶液,电解过程中,阴极上的电极反应为:Cu2++2e-=Cu,
当左池析出1.6gCu,物质的量=1.6mol64g/mol=0.025molCu时,转移电子为0.025mol×2=0.05mol,
由选项可知,金属阳离子只有银离子放电,即生成的银为0.45g,转移电子物质的量=0.45g108g/mol×1=0.0042mol<0.05mol,说明氢离子还放电,故右池中的溶质为硝酸银,故选A.
本题解析:
本题难度:简单
3、选择题 用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如下图,则下列说法不正确的是
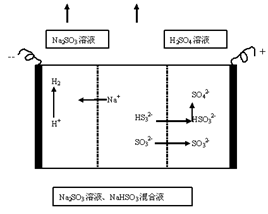
A.阴极区电极反应式为:2H++2e-=H2↑
B.该过程中的副产品主要为H2SO4溶液
C.阳极室内HSO3-.SO32-被氧化为SO42-
D.10L 2mol/L NaOH溶液最多吸收标准状况下224L SO2
参考答案:D
本题解析:A 正确,溶液中的阳离子在阴极得电子。即2H++2e-=H2↑
B 正确,根据图示可知,副产品主要为H2SO4溶液
C 正确,阳极室内HSO3-.SO32-失电子被氧化为SO42-
D 错误,10L 2mol/L NaOH溶液最多吸收标准状况下448L SO2
本题难度:一般
4、选择题 关于下列图示的说法中不正确的是
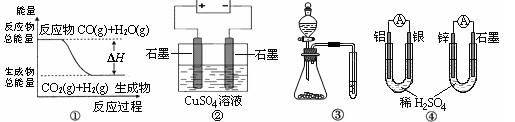
A.图①表示CO(g)+H2O(g) CO2(g)+H2(g)是放热反应
CO2(g)+H2(g)是放热反应
B.图②为电解硫酸铜溶液的装置,电解一段时间后,加入一定量的Cu(OH)2一定不能使溶液恢复到电解前的浓度和体积
C.图③实验装置可一次而又科学准确的完成比较HCl、H2CO3、H2SiO3酸性强弱的实验
D.图④两个装置中通过导线的电子数相同时,正极生成气体的物质的量也相同
参考答案:B
本题解析:略
本题难度:简单
5、选择题 如图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为Pt电极。接通电源后,发现d点显红色。下列有关说法正确的是
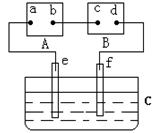
A.e、f极上产生的气体体积比为2:1
B.d极上的电极反应方程式为2Cl--2e-=Cl2↑
C.电源A上的a极是正极
D.电解槽C中溶液的pH增大
参考答案:A
本题解析:略
本题难度:一般