微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列不能说明氯的非金属性比硫强的事实是( )
①HCl比H2S稳定?②HClO氧化性比H2SO4强?③HClO4酸性比H2SO4强?④Cl2能与H2S反应生成S?⑤Cl原子最外层有7个电子,S原子最外层有6个电子?⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS?⑦HCl酸性比H2S强.
A.②⑤⑦
B.①②⑦
C.②④
D.①③⑤
参考答案:①元素的非金属性越强,对应的氢化物越稳定,HCl比H2S稳定,可说明非金属性:Cl>S,故①正确;
②HClO氧化性比H2SO4强不能作为比较非金属性强弱的依据,故②错误;
③元素的非金属性越强,对应的最高价氧化物对应的水化物的酸性越强,HClO4酸性比H2SO4强,可说明非金属性:Cl>S,故③正确;
④Cl2能与H2S反应生成S,可说明氧化性:Cl2>S,单质的氧化性越强,对应元素的非金属性越强,故④正确;
⑤不能以最外层电子数的多少判断非金属性的强弱,例如O的最外层电子数为6,I的最外层电子数为7,但O的非金属性大于I,故⑤错误;
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS,可说明氧化性:Cl2>S,单质的氧化性越强,对应元素的非金属性越强,故⑥正确;
⑦比较非金属性的强弱,应根据对应的最高价氧化物对应的水化物的酸性比较,不能根据氢化物的酸性进行比较,例如HF的酸性比HCl弱,但非金属性F大于Cl,故⑦错误.
故选A.
本题解析:
本题难度:简单
2、选择题 下列递变规律正确的是
A.热稳定性:HCl >HF >H2O
B.沸点:金刚石>冰>干冰
C.碱性:NaOH >Mg(OH)2>Ca(OH)2
D.元素的最高正化合价:F>S>C
参考答案:B
本题解析:非金属性越强,氢化物的稳定性越强,A不正确,应该是HF >H2O> HCl 。金刚石是原子晶体,冰和干冰是分子晶体,水中含有氢键,所以沸点高于干冰的,B正确。金属性越强,最高价氧化物的水化物的碱性越强,C中应该是Ca(OH)2>NaOH >Mg(OH)2。F是最强的非金属,没有正价,D不正确,所以答案选B。
本题难度:简单
3、填空题 下表是元素周期表的一部分,表中字母分别代表某一化学元素,请回答有关问题。

(1)人们曾认为g、h、i不发生化学反应,因而把它们叫做稀有气体,但是后来发现这族气体可以参加化学反应,你认为g、h、i中最有可能首先被发现可以参加化学反应的元素是______________(写元素符号),其原因是_________________。
(2)e是周期表中的___________族,元素原子结构示意图为_______________。
(3)a的阴离子半径____________b的阳离子半径(填大于、等于、小于)。
(4)在元素周期表中有一个对角线规则,其中包括b、c的化合物的性质十分相似。则b的氯化物分别与少量和过量的氢氧化钠溶液发生反应的离子方程式分别为(要表达出具体的元素符号,下同_______________________________;________________________。
(5)f的+4价氧化物可与浓盐酸反应,且已知其氧化性强于氯气,则该氧化物与浓盐酸反应的化学方程式可表示为_________________________。
(6)元素周期表中第6周期中的镧系元素共有___________种,它们原子的电子层结构和性质十分相似。
(7)元素k的氢化物乙可由两种10个电子的微粒组成的化合物甲(化学式X3Y2)与水剧烈反应能生成。甲与水反应的化学反应方程式为:________________________。甲属于_______________晶体(类型)。工业上生产化合物乙时,既要增大乙的产量,又要提高乙的产率,可采取的措施是(填写下列合理选项的序数)_______________。
①减压 ②加压 ③升温 ④降温 ⑤适宜的温度和压强 ⑥加催化剂
⑦及时从平衡体系中分离出乙 ⑧分离出乙后的原料气循环使用并补充原料
参考答案:(1)Xe;从上到下,原子半径增大,失去电子越来越容易
(2)VIII;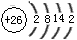
(3)大于
(4)Be2++2OH-=Be(OH)2↓;Be2++4OH-=BeO22-+2H2O
(5)PbO2+4HCl=PbCl2+Cl2↑+2H2O
(6)15
(7)Mg3N2+6H2O=3Mg(OH)2+2NH3;离子;⑤⑥⑦⑧
本题解析:
本题难度:困难
4、选择题 用如图所示装置进行实验,实验现象正确的是
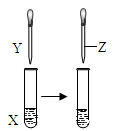
?
| X
| Y
| Z
| 实验现象
|
A
| 苯酚浑浊液
| NaOH溶液
| 盐酸
| 浑浊液变澄清,后又变浑浊
|
B
| FeCl3溶液
| KSCN溶液
| 饱和KCl溶液
| 溶液变为红色,后颜色加深
|
C
| KI溶液
| 足量氯水
| 乙醇
| 溶液变为黄色,后溶液分层,上层为紫红色,下层为无色
|
D
| Na2SO3溶液
| Ba(NO3)2溶液
| 盐酸
| 生成白色沉淀,后沉淀溶解,有大量气体生成
|
?
参考答案:A
本题解析:A/苯酚在常温下难溶解于水,当向其中加入NaOH时,发生反应:C6H5OH+NaOH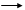 C6H5ONa+H2O.产生容易溶解于水的苯酚钠。这证明了苯酚的弱酸性。当再向其中滴加HCl时,由于酸性HCl> C6H5OH,发生反应:C6H5ONa+HCl
C6H5ONa+H2O.产生容易溶解于水的苯酚钠。这证明了苯酚的弱酸性。当再向其中滴加HCl时,由于酸性HCl> C6H5OH,发生反应:C6H5ONa+HCl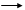 C6H5OH+NaCl.因此会看到现象:浑浊液变澄清,后又变浑浊。正确。B.在FeCl3溶液滴加KSCN溶液,发生反应:Fe3++3SCN-
C6H5OH+NaCl.因此会看到现象:浑浊液变澄清,后又变浑浊。正确。B.在FeCl3溶液滴加KSCN溶液,发生反应:Fe3++3SCN- Fe(SCN)3,溶液变为血红色,再滴加饱和KCl溶液时,由于没有增大反应物或生成物的浓度,所以后来溶液的颜色无明显的变化。错误。C. KI溶液中滴加足量氯水,发生反应:Cl2+2KI===2KCl+I2?。由于I2在乙醇中的溶解度比在水中的大,但是乙醇与水互溶,所以再加入乙醇时,不会出现分层现象。错误。D.Na2SO3溶液中滴加Ba(NO3)2溶液,发生沉淀反应:Na2SO3+ Ba(NO3)2= BaSO3↓+ 2NaNO3.再滴加HCl时发生反应3BaSO3↓+2H++ 2NO3-= 3BaSO4↓+2NO↑+H2O。后沉淀仍然存在,有大量气体生成。错误。
Fe(SCN)3,溶液变为血红色,再滴加饱和KCl溶液时,由于没有增大反应物或生成物的浓度,所以后来溶液的颜色无明显的变化。错误。C. KI溶液中滴加足量氯水,发生反应:Cl2+2KI===2KCl+I2?。由于I2在乙醇中的溶解度比在水中的大,但是乙醇与水互溶,所以再加入乙醇时,不会出现分层现象。错误。D.Na2SO3溶液中滴加Ba(NO3)2溶液,发生沉淀反应:Na2SO3+ Ba(NO3)2= BaSO3↓+ 2NaNO3.再滴加HCl时发生反应3BaSO3↓+2H++ 2NO3-= 3BaSO4↓+2NO↑+H2O。后沉淀仍然存在,有大量气体生成。错误。
本题难度:一般
5、选择题 由地壳中含量第一、第二的两种元素形成的化合物,不具有的性质是
A.高温下可与生石灰发生化合反应
B.熔点高
C.与水作用生成相应的酸
D.与碳共热可发生置换反应
参考答案:C
本题解析:由题目条件可推该化合物是二氧化硅。
A正确,SiO2+CaO=CaSiO3
B正确,二氧化硅是原子晶体,具有熔点高,硬度大等特点。
C错误,二氧化硅不溶于水。
D正确,二氧化硅在高温下与碳反应可以生成硅单质。
本题难度:一般