微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:2M(g)?N(g);△H<0.现将M和N的混和气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如图所示.下列说法正确的是( )

A.a、b、c、d四个点中处于平衡状态的点是a、b
B.反应进行至25min时,曲线发生变化的原因是加入了0.4molN
C.若40min后出现如图所示变化,则可能是加入了某种催化剂
D.若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度
参考答案:由图象可知,10min达平衡时,标有b、d点的曲线物质的物质的量浓度变化为0.6mol/L-0.2mol/L=0.4mol/L,标有a、c点的曲线物质的物质的量浓度变化为0.6mol/L-0.2mol/L=0.4mol/L,由2M(g)?N(g)可推知标有b、d点的曲线为物质M的变化曲线,另一条线为物质N的变化曲线.反应从逆方向开始,N的起始浓度为0.6mol/L,M的起始浓度为0.2mol/L.?
A、a、b、c、d四个点中只有b、d所在曲线浓度保持不变,处于平衡状态,故A错误;
B、由图象可知,25min时,瞬间M的浓度由0.6mol/L增大为1mol/L,N的浓度不变,所以加入M的物质的量为(1mol/L-
0.4mol/L)×1L=0.4mol,故B错误;
C、40 min后,M、N的浓度均发生变化增大,不可能是加入催化剂,平衡不移动,不可能是增大压强,应为同时加入M、N,改变M、N的浓度,故C错误;
D、0.50.5+0.7=42%,15min时N的百分含量为0.40.4+0.6=40%,35min时N的百分含量比15min时高,要使两处N的百分含量相等,则平衡向生成M的方向移动,即向吸热方向移动,应该升高温度,故D正确.
故选:D.
本题解析:
本题难度:一般
2、选择题 下列关于化学反应速率的说法中,不正确的是
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.在容积不变的反应器中,化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示
C.对应化学反应来说,反应速率越大,反应现象就越明显
D.化学反应速率是可以通过实验测定的
参考答案:C
本题解析:考查化学反应速率的概念及其有关判断。化学反应速率的快慢与反应的现象是否明显无关系,所以选项C不正确,其余都是正确的,答案选C。
本题难度:一般
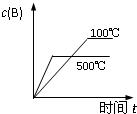
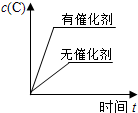
3、选择题 对于可逆反应:2A(g)+B(g)?2C(g);△H<0,下列各图正确的是(设变化过程中物质的聚集状态没有发生改变)( )
A.
B.

C.
D.

参考答案:A、该反应为放热反应,温度升高平衡向逆反应方向移动,C的质量分数减小,故A正确;
B、根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,正逆反应速率都增大,且V正>V逆,故B错误;
C、催化剂同等程度地改变正逆反应速率,平衡不发生移动,故C错误;
D、该反应为放热反应,温度升高平衡向逆反应方向移动,A的转化率降低,根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,A的转化率增大,本题温度的曲线不正确,故D错误.
故选A.
本题解析:
本题难度:一般
4、选择题 一定温度下,在一定体积的密闭容器内,可逆反应2NO(g)+Br2(g) 2NOBr(g)中,Br2的物质
2NOBr(g)中,Br2的物质
的量n(Br2)随时间变化的实验数据如下表:
时间/min
| 5
| 10
| 15
| 20
| 25
| 30
|
n(Br2)/mol
| 0.080
| 0.075
| 0.072
| 0.070
| 0.070
| 0.070
|
根据表中数据,该反应达到平衡状态所需的时间是
A.5min B.10min C.15min D.20min
参考答案:D
本题解析:可逆反应达到化学平衡状态时,Br2的浓度保持不变,选D。
考点:考查化学平衡状态的判断。
本题难度:一般
5、填空题 同质量的锌与盐酸反应,欲使反应速率增大,选用的反应条件正确的组合是___________。
反应条件:①锌粒;②锌片;③锌粉;④5%盐酸;⑤10%盐酸;⑥15%盐酸;⑦加热;⑧用冷水冷却;⑨不断震荡;⑩迅速混合后静置。
欲使反应速率进一步增大,可采取的措施是(列举一条)_____________________。
参考答案:③⑥⑦⑨;滴入几滴硫酸铜溶液
本题解析:
本题难度:一般