|
|
|
高考化学知识点整理《盐类水解的原理》高频试题强化练习(2017年最新版)(四)
2017-09-25 19:14:58
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知HF比CH3COOH易电离。关于物质的量浓度、体积都相同的NaF溶液和CH3COOH溶液,下列说法正确的是
A.CH3COONa溶液中,c(CH3COO-)> c(Na+) >c(OH-) >c(H+)
B.在相同条件下,两溶液的pH大小为:CH3COONa<NaF
C.两溶液相比较,CH3COONa溶液中的离子总数多
D.CH3COONa溶液中,c(H+)+c(CH3COOH)=c(OH-)
|
参考答案:D
本题解析:由HF比CH3COOH易电离可知,HF酸性大于醋酸。A选项,应为c(Na+)>c(CH3COO-)>c(OH-) >c(H+),错误。B选项,由于HF酸性大于醋酸,故两溶液的pH大小为:CH3COONa>NaF。错误。C选项,两溶液相比较,由于醋酸根水解程度大于F-,故CH3COONa溶液中的离子总数小于NaF的离子总数。错误。D选项,正确。
考点:离子浓度比大小。盐类水解。
本题难度:困难
2、选择题 NH4Cl溶于重水(D2O)后,产生的一水合氨和水合氢离子均表示正确的是
[? ]
A.NH2D·H2O和D3O+
B.NH3·D2O和HD2O+
C.NH3·HDO和D3O+
D.NH2D·HDO和H2DO+
参考答案:C
本题解析:
本题难度:一般
3、填空题 许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1)重晶石(BaSO4)常做胃肠道造影剂。已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)= ;
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4 c.(NH4)2SO4 d.(NH4)2SO3
其中c(NH4+)由大到小的顺序为 (填选项字母);
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为 ;
②样品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g样品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以 为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-= 2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该样品中K2S2O8的质量分数为(杂质不参加反应) _(结果保留三位有效数字)。
参考答案:
(1)2.2×10-8mol/L( 未写单位不得分) (2)a>c>d>b
(2)①5S2O32-+2Mn2++8H2O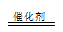 10SO42-+2MnO4-+16H+ (没写反应条件给分) 10SO42-+2MnO4-+16H+ (没写反应条件给分)
②淀粉 94.5%
本题解析:(1)Ksp(BaSO4)=1.1×10-10,当溶液的pH=2时,c(SO42-) ="0.005" mol/L ,c(Ba2+)= Ksp(BaSO4)/ c(SO42-)=2.2×10-8mol/L ;
(2)等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 ,c.(NH4)2SO4 ,d.(NH4)2SO3 中NH4+浓度大于b.NH4HSO4 ,a.Fe2+和NH4+水解相互抑制,d. NH4+和SO32-水解相互促进。所以c(NH4+)由大到小的顺序为a>c>d>b;
(3)过二硫酸钾(K2S2O8)常做强氧化剂,①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,Mn2+被氧化成MnO4-,S2O82-被还原,5S2O32-+2Mn2++8H2O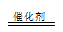 10SO42-+2MnO4-+16H+,②因为该反应涉及I2,可以用淀粉溶液作指示剂;由I2+2S2O32-= 2I-+S4O62-得关系: n(S2O82-)--2n(S2O32-);已知n(S2O32-)=2.1×10-3mol; 求得n(S2O82-)=1.05×10-3mol;w(K2S2O8)=270g/mol×1.05×10-3mol /0.3g×100 10SO42-+2MnO4-+16H+,②因为该反应涉及I2,可以用淀粉溶液作指示剂;由I2+2S2O32-= 2I-+S4O62-得关系: n(S2O82-)--2n(S2O32-);已知n(S2O32-)=2.1×10-3mol; 求得n(S2O82-)=1.05×10-3mol;w(K2S2O8)=270g/mol×1.05×10-3mol /0.3g×100
本题难度:困难
4、选择题 为了使K2S溶液中c(K+)/c(S2-)的比值变小,可加入的物质是
①适量HCl(g);②适量NaOH(s);③适量KOH(s);④适量NaHS(s);⑤适量的水
A.②④
B.①②⑤
C.③④⑤
D.②③
|
参考答案:A
本题解析:S2-+H2O=OH-+HS-,S2—的水解平衡逆向移动,[K+]/[S2—]的比值变小。①氢离子浓度增大,使水解平衡正向移动,错误;②氢氧根离子浓度增大,使水解平衡逆向移动,正确;③②氢氧根离子浓度增大,使水解平衡逆向移动,但K+浓度增大,错误;④HS-浓度增大,使水解平衡逆向移动,正确;⑤加水稀释,各离子浓度都减小,平衡正向移动,S2-数目减少,[K+]/[S2—]的比值增大。
考点:考查化学平衡移动。
本题难度:一般
5、选择题 在Na2S溶液中,c(Na+)与c(S2-)的关系是
A.c(Na+)=c(S2-)
B.c(Na+)∶c(S2-)=2∶1
C.c(Na+)∶:c(S2-)>2∶1
D.c(Na+)∶c(S2-)<2∶1
参考答案:C
本题解析:
本题难度:一般