微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:①软锰矿与过量KOH、KC1O3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转变为MnO2和KMnO4;③滤去MnO2,将滤液浓缩、结晶得深紫色的KMnO4产品。
(1)制备过程中,为了提高原料的利用率,可采取的措施是?。
(2)滤液酸化时,K2MnO4转变为MnO2和KMnO4的离子方程式是?。
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定
①配制250mL0.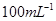 ?标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量
?标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量
? g.
②取上述制得的KMnO4产品0.316g,酸化后用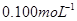 标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为:
标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液12.00mL。计算该KMnO4产品的纯度。(有关离子方程式为: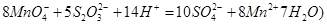
参考答案:(1)将③中MnO2回收利用(2分)
(2)3MnO42-+4H+=MnO2↓+2MnO4-+2H2O(2分)
(3)①3.95(3分)
② 8KMnO4~ 5S2O32-
8×158 g? 5 mol
0.316 g×w 0.100 mol·L-1×12.00 mL×10-3 L·mL-1
w =96%(或0.96)(5分)
本题解析:(1)制备过程中,为了提高原料的利用率,一般是原料的循环使用,即可以将将③中MnO2回收利用。
(2)根据反应物和生成物可知,反应的方程式为3MnO42-+4H+=MnO2↓+2MnO4-+2H2O。
(3)①250mL0.100mol/L 标准Na2S2O3溶液中,溶质的物质的量是0.025mol,质量是0.025mol×158g/mol=3.95g。
②本题可以通过关系式计算。
本题难度:一般
2、选择题 实验室制备Cl2通常采用下列反应:MnO2+4HCl(浓)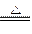 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集干燥、纯净Cl2的装置是:
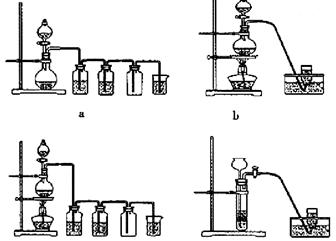
C? d
参考答案:C
本题解析:略
本题难度:一般
3、选择题 实验室在制备气体时,对某些气体来说,收集方法即可采用排水法,又可采用排空气法收集。下列气体中,能同时采用上述两种收集方法的是(?)
A.NH3
B.NO
C.NO2
D.H2
参考答案:D
本题解析:排水法收集气体,要求气体难溶于水,且不与水发生反应;能用向上排空气法收集,要求该气体密度比空气的大且不与空气反应;能用向下排空气法收集,要求该气体密度比空气的小且不与空气反应。
A项中的NH3 易溶于水,不能用排水法收集;密度比空气小,可采用向下排空气法收集,所以A不符合。
B项中的NO会与空气中的氧气反应,不能用排空气法收集;NO难溶于水,且不与水发生反应,可采用排水法收集。所以B不符合。
C项中的NO2?会与水发生反应,不能用排水法收集;不与空气反应且密度比空气大,可采用向上排空气法收集。所以C不符合。
D项中的H2难溶于水且不与水发生反应,不与空气反应且密度比空气小,可采用排水法和向下排空气法收集,所以D符合。故本题选D。
点评:本题考查收集气体的方法。可根据所学知识作答。题目难度不大。
本题难度:简单
4、实验题 研究某一化学反应的实验装置如下图所示:
A~F属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氟水、水、锌粒、铜片、食盐、高锰酸钾、氯化钙、氧化钙、四氧化三铁、氧化铁、氧化铜、氢气、二氧化碳、二氧化氮、一氧化碳、氯气、氯化氢、氨气、氮气、氧气。
实验现象;
(1)D物质由黑色变为红色
(2)无水硫酸铜粉末放入无色透明的E中得到蓝色溶液
(3)点燃的镁条伸入无色无味的F中.镁条表面生成一种灰黄色固体物质。将该发黄色物质放入水中,有气体放出,该气体具有刺激性气味。并能使润湿的红色石蕊试纸变蓝。通过分析回答:
l、写出A~F的物质名称:
A?,B?,C?,D?,E?,F?。
2、写出有关的化学方程式:
A与B?;
C与D?;
E与无水硫酸铜?;
F与Mg?;
F与Mg的反应产物与水?。
参考答案:1、A、浓氨水;B、氧化钙;C、氨气;D、氧化铜;E、水;F、氮气。?
2、NH3·H2O+CaO= NH3↑+Ca(OH)2;
2NH3+3CuO N2+3Cu+3H2O;
N2+3Cu+3H2O;
CuSO4+5H2O= CuSO4·5H2O
N2+3Mg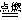 Mg3N2
Mg3N2
Mg3N2+6H2O="3Mg" (OH)2+ 2NH3↑
本题解析:“该气体具有刺激性气味,并能使润湿的红色石蕊试纸变蓝”是解答此题的突破口,此气体只能是NH3,结合题意,F就是N2。因此,从限定的反应物中,只能设法从氨水中获取.然后结合发生装置特点(固、液、不加热)及其他实验现象,便可推断其他的物质。
本题难度:一般
5、实验题 某研究小组探究SO2和Fe(NO3)3溶液的反应。
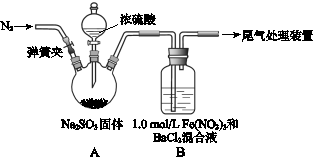
已知: 1.0 mol·L-1的Fe(NO3)3溶液的pH=1,请回答:
(1)装置A中反应的化学方程式是?。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是?。
(3)装置B中产生了白色沉淀,其成分是?,说明SO2具有?性。
(4)分析B中产生白色沉淀的原因:
观点1:?_____________________________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①若观点2正确,装置B中反应的离子方程式是?。
②只需将装置B中的 Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,即可证明观点3是否正确,应选择的试剂是(填序号)?。
a.0.1 mol·L-1稀硝酸?
b.1.5 mol·L-1 Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol/L盐酸等体积混合的溶液
参考答案:(12分)
(1)Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O(2分)
(2)打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹(2分)
(3)BaSO4(1分)?还原性(1分)
(4)观点1:SO2和Fe3+、酸性条件下NO3-都反应(2分)
①SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+(2分;可分两步写,各1分)
②c(2分)
本题解析:(1)装置A中的反应是制取SO2,方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O。
(2)反应前要充入N2,排除装置A中的空气,反应对实验的干扰。
(3)硝酸具有氧化性,白色沉淀为BaSO4,说明SO2具有还原性。
(4)经过分析,各个观点,得出观点1是SO2和Fe3+、酸性条件下NO3-都反应。
①Fe3+把SO2氧化,离子方程式是SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+。
②Fe(NO3)3中有Fe3+,a错;NO3-在酸性条件下有氧化性,b错。故选c。2制备 Fe3+、NO3-的氧化性
点评:本题考查的是SO2制备和Fe3+、NO3-的氧化性的相关知识,题目难度较大,要求学生熟悉所实验的内容及原理,能够考查同学们进行分析问题、解决问题的能力。
本题难度:一般