微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 平衡体系mA(g)+nB(g) pC(g)+qD(g)有下列判断:①温度不变时,将容器体积增大一倍,若A的浓度变为原来的0.48倍,则m+n>p+q②若平衡时A和B的转化率相等,说明起始时A和B的物质的量之比为m:n③若改变一个条件使反应重新达到平衡时,D的浓度增大了,说明平衡向右移动了④若平衡体系中A、B、C、D的物质的量分别为a、b、c、dmol,则再向其中加入a、b、c、dmol的A、B、C、D时,平衡可能不移动⑤若平衡后降低温度,该反应的化学反应平衡常数增大,说明该反应的ΔH>0,其中正确的是(?)?
pC(g)+qD(g)有下列判断:①温度不变时,将容器体积增大一倍,若A的浓度变为原来的0.48倍,则m+n>p+q②若平衡时A和B的转化率相等,说明起始时A和B的物质的量之比为m:n③若改变一个条件使反应重新达到平衡时,D的浓度增大了,说明平衡向右移动了④若平衡体系中A、B、C、D的物质的量分别为a、b、c、dmol,则再向其中加入a、b、c、dmol的A、B、C、D时,平衡可能不移动⑤若平衡后降低温度,该反应的化学反应平衡常数增大,说明该反应的ΔH>0,其中正确的是(?)?
A. ②④? B.②③? C. ①④⑤? D. ①②③
2、选择题 下列反应中,熵显著增加的是(?)
A.CO(g) +2H2(g)=CH3OH(g)
B.CaCO3(s)+2HCI(g)=CaCl2(s)+CO2(g)+H2O(l)
C.2H2(g)+O2(g)=2H2O(l)
D.2HgO(s)=2Hg(l)+O2(g)
3、填空题 (6分)下列反应在210℃时达 到平衡:
到平衡:
①PCl5(g)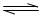 PCl3(g)+C12(g) △H1>0 K1="1" mol·L-1
PCl3(g)+C12(g) △H1>0 K1="1" mol·L-1
②CO(g)+C12(g)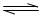 COCl2(g) △H2<O K2=5×104 mol·L-1
COCl2(g) △H2<O K2=5×104 mol·L-1
③COCl2(g)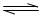 CO(g)+Cl2(g) K3=?
CO(g)+Cl2(g) K3=?
④2SO2(g)+O2(g)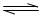 2SO3(g) △H4<0
2SO3(g) △H4<0
(1)反应③的平衡常数K3为  。
。
(2)要使反应①和反应②的K数值相等,可采取的措施是 (填序号,下同)。
A.降低反应①、②体系中Cl2浓度
B.反应①降低温度,反应②维持210℃
C.反应①、反应②同时升高温度
(3)欲使反应④向正方向移动,可采取的措施是
A.恒温下扩大容器体积 B.减少SO3的物质的量
C.恒压下升温
4、选择题 在密闭容器中进行反应X2(g)+3Y2(g)?2Z2(g),若X2、Y2、Z2的起始浓度分别为0?1mol/L、0?3mol/L、0?2mol/L,达到平衡时下列物质的浓度可能为( )
A.X2为0?2mol/L
B.Y2为0?2mol/L
C.Z2为0?4mol/L
D.Y2为0?6mol/L
5、选择题 在一密闭容器中进行如下反应2SO2(g)+O2(g)?

2SO3(g)测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2mol/L、0.1mol/L、0.2mol/L.当反应达到平衡时,下列数据可能存在的是( )
A.SO2、O2浓度分别为0.4mol/L、0.2mol/L
B.SO3浓度为0.4mol/L
C.SO3浓度为0.25mol/L
D.SO3、SO2浓度均为0.15mol/L
[ -page-]
1、选择题 平衡体系mA(g)+nB(g) pC(g)+qD(g)有下列判断:①温度不变时,将容器体积增大一倍,若A的浓度变为原来的0.48倍,则m+n>p+q②若平衡时A和B的转化率相等,说明起始时A和B的物质的量之比为m:n③若改变一个条件使反应重新达到平衡时,D的浓度增大了,说明平衡向右移动了④若平衡体系中A、B、C、D的物质的量分别为a、b、c、dmol,则再向其中加入a、b、c、dmol的A、B、C、D时,平衡可能不移动⑤若平衡后降低温度,该反应的化学反应平衡常数增大,说明该反应的ΔH>0,其中正确的是(?)?
pC(g)+qD(g)有下列判断:①温度不变时,将容器体积增大一倍,若A的浓度变为原来的0.48倍,则m+n>p+q②若平衡时A和B的转化率相等,说明起始时A和B的物质的量之比为m:n③若改变一个条件使反应重新达到平衡时,D的浓度增大了,说明平衡向右移动了④若平衡体系中A、B、C、D的物质的量分别为a、b、c、dmol,则再向其中加入a、b、c、dmol的A、B、C、D时,平衡可能不移动⑤若平衡后降低温度,该反应的化学反应平衡常数增大,说明该反应的ΔH>0,其中正确的是(?)?
A. ②④? B.②③? C. ①④⑤? D. ①②③
参考答案:A
本题解析:容器体积增大一倍,A浓度变为原来的一半,平衡时A浓度变为原来的0.48倍,说明扩大体积平衡向右移动,所以m+n<p+q,①错误;反应中A、B计量数比为m:n,若平衡时A、B转化率相等,说明起始时A、B物质的量比为m:n,②正确;D浓度增大,平衡不一定向右移动,如增大D的浓度,D浓度增大,平衡向左移动,③错误;浓度加倍等效于增大压强,若m+n=p+q,平衡不移动,④正确;降低温度,平衡向放热反应方向移动,平衡常数增大,说明平衡向右移动,⑤错误。
点评:浓度加倍,等效于增大压强;生成物浓度增大,平衡不一定向右移动。
本题难度:简单
2、选择题 下列反应中,熵显著增加的是(?)
A.CO(g) +2H2(g)=CH3OH(g)
B.CaCO3(s)+2HCI(g)=CaCl2(s)+CO2(g)+H2O(l)
C.2H2(g)+O2(g)=2H2O(l)
D.2HgO(s)=2Hg(l)+O2(g)
参考答案:D
本题解析:A、B、C项气体分子数减少,熵值减少;D项气体分子数增加,熵值增加。
本题难度:简单
3、填空题 (6分)下列反应在210℃时达 到平衡:
到平衡:
①PCl5(g)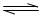 PCl3(g)+C12(g) △H1>0 K1="1" mol·L-1
PCl3(g)+C12(g) △H1>0 K1="1" mol·L-1
②CO(g)+C12(g)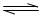 COCl2(g) △H2<O K2=5×104 mol·L-1
COCl2(g) △H2<O K2=5×104 mol·L-1
③COCl2(g)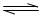 CO(g)+Cl2(g) K3=?
CO(g)+Cl2(g) K3=?
④2SO2(g)+O2(g)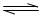 2SO3(g) △H4<0
2SO3(g) △H4<0
(1)反应③的平衡常数K3为  。
。
(2)要使反应①和反应②的K数值相等,可采取的措施是 (填序号,下同)。
A.降低反应①、②体系中Cl2浓度
B.反应①降低温度,反应②维持210℃
C.反应①、反应②同时升高温度
(3)欲使反应④向正方向移动,可采取的措施是
A.恒温下扩大容器体积 B.减少SO3的物质的量
C.恒压下升温
参考答案:
(1)2×10-5 mol·L-1 (2分)
(2)C (2分)
(3)B (2分)
本题解析:略
本题难度:一般
4、选择题 在密闭容器中进行反应X2(g)+3Y2(g)?2Z2(g),若X2、Y2、Z2的起始浓度分别为0?1mol/L、0?3mol/L、0?2mol/L,达到平衡时下列物质的浓度可能为( )
A.X2为0?2mol/L
B.Y2为0?2mol/L
C.Z2为0?4mol/L
D.Y2为0?6mol/L
参考答案:A、X2的浓度增大,说明反应向逆反应方向进行建立平衡,若生成X20?1mol/L,则Y2、Z2的浓度浓度变化分别为
0.3mol/L、0.2mol/L,Y2、Z2不可能完全转化,故A错误;
B、Y2的浓度增减小,说明反应向正反应方向进行建立平衡,若Y2减小0?1mol/L,则X2的浓度浓度减小为0.03mol/L,生成
Z2为0.067,故B正确;
C、Z2的浓度为0?4mol/L,说明反应向正反应方向进行建立平衡,若生成Z20?2mol/L,则X2、Y2的浓度浓度变化分别为
0.1mol/L、0.3mol/L,X2、Y2不可能完全转化,故C错误;
D、Y2的浓度为0?6mol/L,说明反应向逆反应方向进行建立平衡,若生成Y20?3mol/L,则消耗Z2的浓度为0?2mol/L,Z2不可能完全转化,故D错误.
故选B.
本题解析:
本题难度:简单
5、选择题 在一密闭容器中进行如下反应2SO2(g)+O2(g)?

2SO3(g)测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2mol/L、0.1mol/L、0.2mol/L.当反应达到平衡时,下列数据可能存在的是( )
A.SO2、O2浓度分别为0.4mol/L、0.2mol/L
B.SO3浓度为0.4mol/L
C.SO3浓度为0.25mol/L
D.SO3、SO2浓度均为0.15mol/L
参考答案:2SO2(g)+O2(g)?

2SO3(g),
某时刻0.2mol/L 0.1mol/L? 0.2mol/L
极限转化0.4mol/L 0.2mol/L? 0
极限转化 0? 0? 0.4mol/L
A、由于反应为可逆反应,SO2的浓度一定小于0.4mol/L,O2浓度小于0.2mol/L,故A错误;
B、由于反应为可逆反应,SO3的浓度一定小于0.4mol/L,故B错误;
C、于反应为可逆反应,SO3的浓度一定小于0.4mol/L,大于0,则可能为0.25mol/L,故C正确;
D、SO3、SO2浓度不会均为0.15mol/L,只能一种物质的浓度增大,另一种物质的浓度减小,故D错误;
故选C.
本题解析:
本题难度:一般