微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
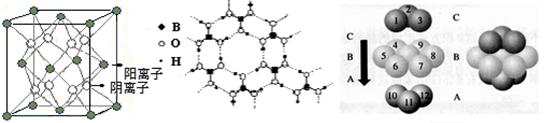
1、填空题 (10分)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2与水反应生成乙炔的化学方程式?;
CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为?_________________________。
(2)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是?;分子中处于同一直线上的原子数目最多为?。
(3)金刚石的晶胞如图所示,已知六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,立方氮化硼晶体密度为ag/cm3, 表示阿伏加德罗常数,则立方氮化硼晶胞体积为?cm3。
表示阿伏加德罗常数,则立方氮化硼晶胞体积为?cm3。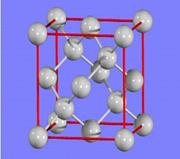
参考答案:(1)CaC2+2H2O→Ca(OH)2+C2H2↑(2分)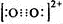 ?(2分)?
?(2分)?
(2)sp杂化?sp2杂化(2分)? 3(1分)?(3)100/aNA?(3分)
本题解析:(1)考查乙炔的实验室制取。C22-含有14个电子,所以O22+的电子式可表示为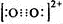 。
。
(2)丙烯腈分子中含有碳碳双键和碳碳三键,所以碳碳三键的碳原子是sp杂化,碳碳双键的碳原子是sp2杂化。由于碳碳三键是直线型结构,而碳碳双键是直线型结构,所以分子中处于同一直线上的原子数目最多为3个。
(3)结构与金刚石相似,所以晶胞中含有的氮原子和硼原子的个数都是4个,所以该晶胞的质量是4×25/NA,因此体积是100/aNA。
本题难度:简单
2、填空题 (10分)按下列要求回答:现有①BaCl2;②金刚石;③NH4Cl;④Na2SO4;⑤干冰;⑥碘
(1)熔化时不需要破坏化学键的是__________(填序号,下同),熔点最低的是__________。
(2)属于离子化合物的是__________
(3)①的电子式是________________,⑤的电子式是________________。
参考答案:(10分) (1)⑤⑥ ?⑤ ? (2)①③④
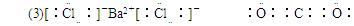
本题解析:略
本题难度:一般
3、填空题 已知A、B、C、D均为周期表中前36号元素,且原子序数依次增大。A、B、C为同一周期的主族元素,A原子最外层有3个未成对电子,B原子p能级电子总数与s能级电子总数相等。D是周期表1~18列中的第10列元素。请回答:
(1)C的电子排布图为___________。
(2)A、B两元素的第一电离能较大的是____(填写元素符号)。
(3)A的氢化物的VSEPR模型立体结构为__________。
(4)D属于元素周期表中第____周期____族元素,它的+2价离子的电子排布式为__________。
(5)元素D的氧化物DO晶体结构与NaCl晶体结构相同,已知D2-与最近O2-的核间距离为acm,DO的摩尔质量为M g/mol,若用“NA”表示阿伏加德罗常数, 则DO晶体的密度为_________。
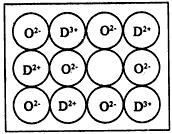
(6)天然的和绝大部分人工制备的晶体都存在各种缺陷,某种DO晶体中就存在如图所示的缺陷:一个
D2+空缺,另有两个D2+被两个D+所取代。其结果晶体仍呈电中性,但化合物中D和O的比值却发生了变化。其氧化D样品组成为D0.97O,则该晶体中D3+与D2+的离子个数比为____。
参考答案:(1)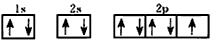 (2)N
(2)N
(3)四面体
(4)四;Ⅷ;1s22s22p63s23p63d8(5)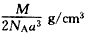 (6)Ni3+:Ni2+=6:91
(6)Ni3+:Ni2+=6:91
本题解析:
本题难度:一般
4、填空题 决定物质性质的重要因素是物质结构。请回答下列问题。
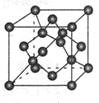
(1)下图是石墨的结构,其晶体中存在的作用力有?(填序号)
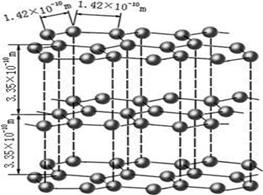
Aσ键;Bπ键;C氢键;D配位键;E分子间作用力;F金属键;G离子键
(2)下面关于晶体的说法不正确的是___________
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF> NaCl> NaBr>NaI
 ?
?