微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 等质量的两种气体SO2和SO3,其物质的量之比为?,二者所含O原子个数之比为?,在同温同压下的体积之比为?。
参考答案:5:4 ;5:6 ;5:4
本题解析:根据n=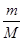 =
=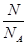 =
=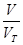 解:设SO2与SO3均为1g,则n(SO2):n(SO3)=
解:设SO2与SO3均为1g,则n(SO2):n(SO3)=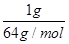 :
: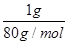 =5:4;则SO2中n(O)=2n(SO2)=2×
=5:4;则SO2中n(O)=2n(SO2)=2×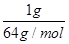 ,SO3中n(O)="3" n(SO3)=3×
,SO3中n(O)="3" n(SO3)=3×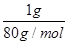 ,则氧原子个数比为5:6;据阿伏加德罗定律,体积之比等于物质的量之比,即V(SO2):V(SO3)= n(SO2):n(SO3)=5:4。
,则氧原子个数比为5:6;据阿伏加德罗定律,体积之比等于物质的量之比,即V(SO2):V(SO3)= n(SO2):n(SO3)=5:4。
本题难度:一般
2、选择题 向20mL 2mol/L AlCl3溶液中加入30mL NaOH溶液,充分反应后得到0.78g沉淀,则NaOH溶液的物质的量浓度是(?)
A.1mol/L
B.2mol/L
C.5mol/L
D.8mol/L
参考答案:AC
本题解析:略
本题难度:简单
3、选择题 由锌、铁、铝、镁四种金属的两种组成的混合物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混合物中一定含有的金属是(?)
A.锌
B.铁
C.铝
D.镁
参考答案:C
本题解析:氢气的物质的量是11.2L÷22.4L/mol=0.5mol,则需要锌、铁、铝、镁四种金属的质量分别是32.5g、28g、9g、12g。因此根据平均值原理可知。一定含有的金属应该是铝,答案选C。
点评:该题是高考中的常见题型和考点,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和灵活应变能力。该题的关键是明确反应原理,然后借助于平均值原理列式计算即可。
本题难度:一般
4、填空题 将24.4gNaOH固体溶于水配成100mL溶液,其密度为1.22g/mL.
(1)该溶液中NaOH的物质的量浓度为______.
(2)该溶液中NaOH的质量分数为______.
(3)从该溶液中取出10mL,其中NaOH的物质的量浓度为______,NaOH的质量分数为______,溶液的密度为______,含NaOH的质量为______,含NaOH的物质的量为______.
(4)将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______.
参考答案:22.4gNaOH的物质的量为24.4g40g/mol=0.61mol,溶液质量为100mL×1.22g/mL=122g,
(1)该溶液中NaOH的物质的量浓度为0.61mol0.1L=6.1mol/L,
故答案为:6.1mol/L;
(2)该溶液中NaOH的质量分数为24.4g122g×100%=20%,故答案为:20%;
(3)溶液是均匀的,取出10mL溶液的物质的量浓度、质量分数、密度与原溶液相等,故溶液的物质的量浓度、质量分数、密度分别为6.1mol/L、20%、1.22g/mL,
该10mL溶液中氢氧化钠的质量、物质的量为原溶液中的110,分别为2.44g、0.061mol,
故答案为:6.1mol/L;20%;1.22g/mL;2.44g;0.061mol;
(4)取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为0.061mol0.1L=0.61mol/L,
故答案为:0.61mol/L.
本题解析:
本题难度:一般
5、计算题 (5分)现有一含少量SiO2杂质的石灰石样品,某实验小组同学为准确测定该样品的纯度,他们取用2.0g样品于烧杯中,把25.00mL某浓度的盐酸分成5等份,准备分别加入烧杯中进行反应,他们将前4次实验的结果记录如下:
次序
| 盐酸
| 剩余固体
|
1
| 先加入5.00mL
| 1.32g
|
2
| 再加入5.00mL
| 0.64g
|
3
| 再加入5.00mL
| 0.2g
|
4
| 再加入5.00mL
| 0.2g
|
?
(1)该实验小组同学是否还需要将第5份盐酸加入烧杯??;
(2)原样品的纯度(CaCO3的质量分数)是______________。
(3)求该实验小组同学所用盐酸的物质的量浓度。(要求写出计算过程)
参考答案:
(1)不需要(1分)(2)90%(2分)
(3)2.72
本题解析:根据 CaCO3——2HCl 有:
(2.0—1.32)g×2/100g·mol—1=0.005L×c(HCl)
c(HCl)="2." 72mol/L。
本题难度:简单