|
高中化学知识点归纳《影响化学反应速率的因素》考点巩固(2017年最新版)(二)
2017-09-25 19:25:49
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把镁条投入到盛有盐酸的敞口容器中,下列因素对产生H2速率没有影响的是
A.Cl-的浓度
B.镁条的表面积
C.溶液的温度
D.H+的浓度
|
参考答案:A
本题解析:A、镁和盐酸反应过程中氯离子没有参与反应,故氯离子浓度不影响反应速率,选A;B、镁条的表面积影响反应速率,不选B;C、温度对速率有影响,不选C;D、氢离子的浓度大小影响反应速率,不选D。
考点:反应速率的影响因素。
本题难度:一般
2、填空题 (1)下面各个小题已经给出了化学反应的反应物,试写出完整的化学反应方程式并配平:(每小题2分,共6分)
过量乙酸与甘油的酯化反应?
蔗糖水解:?
CH3CH(OH)CH3的催化氧化:?
(2)(4分).硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI?Ⅱ.2HI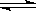 H2+I2?Ⅲ.2H2SO4===2SO2+O2+2H2O H2+I2?Ⅲ.2H2SO4===2SO2+O2+2H2O
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,生成的I2为气体,H2物质的量随时间的变化如图所示。0-2 min内的平均反应速率υ(HI)=?

(2)实验室用Zn和硫酸制取H2,为了加快反应速率,下列措施不可行的是?(填序号)
a.加入浓硝酸?b.加入少量CuSO4固体? c.用粗锌代替纯锌
d.加热? e.把锌粒弄成锌粉? f.用98.3%浓硫酸
参考答案:(1)(每小题3分,共6分)
3CH3COOH+CH2OHCHOHCH2OH 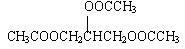 +3H2O +3H2O

2CH3CHOHCH3+O2 2CH3COCH3+2H2O 2CH3COCH3+2H2O
(2)(4分)(1)0.1mol/(L·min)---2分,?(2)a、f--2分
本题解析:(1)甘油中含有3个羟基,所以和乙酸发生酯化反应,消耗3分子乙酸。蔗糖是二糖,水解生成葡萄糖和果糖。2-丙醇中和羟基相连的碳原子上只有1个氢原子,催化氧化的产物是丙酮。
(2)根据图像可知,平衡时氢气的物质的量是0.1mol,所以消耗碘化氢是0.2mol,因此其反应速率是 。 。
(3)考查外界条件对反应速率的影响。浓硝酸和浓硫酸都是氧化性酸,和锌反应生成物不是氢气。b和c中可以构成原电池,反应速率可以加快。温度升高,反应速率加快。e是增大反应物的接触面积,反应速率加快。所以答案选af。
本题难度:一般
3、选择题 对于在一定条件下进行的化学反应:2SO2+O2?2SO3,改变下列条件,可以提高反应物中的活化分子百分数的是( )
A.降低温度
B.增大压强
C.使用催化剂
D.增大反应物浓度
参考答案:加入催化剂可提高反应物中的活化分子百分数;降低温度降低反应物中的活化分子百分数,而压强和浓度只改变活化分子的数目,不改变百分数,
故选C.
本题解析:
本题难度:简单
4、选择题 下列说法正确的是
A.增大压强,活化分子百分数增大,反应速率一定增大
B.升高温度,反应物分子总数增加,活化分子百分数不变,反应速率一定增大
C.加入反应物,使活化分子百分数增大,反应速率增大
D.使用催化剂可降低反应的活化能,增大活化分子百分数,增大反应速率
参考答案:D
本题解析:
本题主要考查:用有效碰撞理论解释化学反应速率改变的微观因素。学生解决问题时要理清:活化分子个数,活化分子百分数,活化能等概念。
A:错在没有理解压强作用的前提条件是对于有气体物质的化学反应。
B:错在没有理解:升高温度是提高了反应物分子的能量,活化能不变,活化分子个数增加,活化分子百分数相应增大。
C:错在没有理解:其它条件不变时,加入反应物,反应物分子总个数和活化分子个数按相同倍数增加,活化分子百分个数不变。
D:正确。
本题难度:简单
5、选择题 一定能使反应速率加快的因素是:( )
①扩大容器的容积②使用催化剂③增加反应物的质量④升高温度⑤缩小容积.
A.②③
B.②③④
C.②③④⑤
D.④
参考答案:①扩大容器的容积,如果有气体参加反应,则降低反应速率,如果没有气体参加,则不影响反应速率,故错误;
②使用催化剂不一定加快反应速率,如果加入的是负催化剂,则降低反应速率,故错误;
③增加反应物的质量,反应物的浓度不一定增大,如固体和纯液体,所以不一定加快反应速率,故错误;
④无论是放热反应还是吸热反应,只要升高温度,反应速率就加快,故正确;
⑤缩小容积,浓度不一定增加,如固体、纯液体,反应不一定加快,故错误;
故选D.
本题解析:
本题难度:简单
|