微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (2分)在下列事实中,什么因素影响了化学反应的速率 ?
?
(1)夏天的食品容易霉变,冬天就不容易发生该现象 。
(2)熔化的氯酸钾放出气泡很慢,撒入少量二氧化锰很快产生气体 。
2、选择题 其他条件不变时,能使反应速率加快的是(?)
A.对于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,增大体系的压强
B.对于N2(g)+3H2(g) 2NH3(g),容器体积固定不变时,充入Ar
2NH3(g),容器体积固定不变时,充入Ar
C.对于N2(g)+3H2(g) 2NH3(g),容器体积固定不变时,充入N2
2NH3(g),容器体积固定不变时,充入N2
D.对于N2(g)+3H2(g) 2NH3(g),容器气体压强不变时,充入Ar
2NH3(g),容器气体压强不变时,充入Ar
3、选择题 可逆反应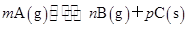
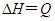 ,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
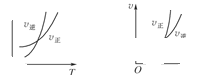
A.m>n,Q>0
B.m>n+p,Q>0
C.m>n,Q<0
D.m<n+p,Q<0
4、实验题 某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色先慢后快,即反应速率由小变大。小组成员为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种,并为此设计实验进行探究验证。
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:……。
【实验目的】探究草酸与高锰酸钾反应的速率变化“异常”原因
【实验用品】仪器:试管、胶头滴管、量筒、药匙、玻璃棒等;
试剂:0.1mol/L H2C2O4溶液、0.05mol/L KMnO4(硫酸酸化)溶液等。
请你根据该兴趣小组的实验探究设计思路,补充完整所缺内容。
(1)草酸(H2C2O4,弱酸)与酸性KMnO4溶液反应的离子方程式为(已知:MnO4_还原产物是Mn2+) 。
(2)要完成对猜想Ⅰ的实验验证,至少还需要一种实验仪器是 。
(3)猜想Ⅱ可能是______________________________________________________________。要设计实验验证猜想Ⅱ,进行该实验还要补充一种试剂及一种仪器,分别是 。
(4)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容。
| 试管A
| 试管B
|
加入试剂
|
|
|
(预期)实验现象
(褪色时间)
|
|
|
结论
| 猜想Ⅱ正确
|
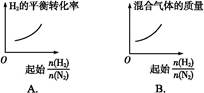
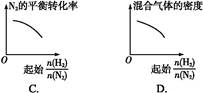
5、选择题 在相同温度下,将H2和N2两种气体按不同比例通入相同的恒容密闭容器中,发生反应:3H2+N2 2NH3。
2NH3。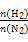 表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是(?)
表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是(?)