|
高中化学知识点归纳《影响化学反应速率的因素》考点巩固(2017年最新版)(四)
2017-09-25 19:25:49
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将CoCl2溶解于盐酸中可以形成[CoCl4]2-,在溶液中存在下面的化学平衡:
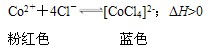
下列说法正确的是
A.该反应的平衡常数K=
B.升高温度,正反应速率增大,逆反应速率减小
C.将盛有CoCl2和盐酸混合液的试管置于热水中,试管内溶液为红色
D.增大Cl-浓度,平衡向正反应方向移动,Co2+、Cl-浓度都减小
|
参考答案:A
本题解析:化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,选项A正确;升高温度,正逆反应速率都是增大的,选项B不正确;正反应是吸热反应,升高温度,平衡向正反应方向移动,溶液显蓝色,选项C不正确;增大Cl-浓度,平衡向正反应方向移动,Co2+浓度减小,根据勒夏特列原理可知,Cl-浓度是增大的,选项D不正确,答案选A。
本题难度:一般
2、选择题 一定量的盐酸跟足量镁粉反应时,为了减缓化学反应速率,且不影响生成的H2的总量,可向盐酸中加入适量的
[? ]
A.NaOH固体
B.H2O
C.CH3COONa固体
D.醋酸
参考答案:BC
本题解析:
本题难度:一般
3、选择题 设C+CO2?2CO-Q1,反应速率v1;N2+3H2?2NH3+Q2反应速率v2.对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.同时增大
B.同时减小
C.v1增大,v2减小
D.v1减小,v2增大
参考答案:升高温度时,活化分子的百分数增大,正逆反应速率都增大,吸热反应或放热反应的速率都增大,与吸放热无关.
故选A.
本题解析:
本题难度:简单
4、简答题 (1)某化学课外研究小组,设计实验探究KI溶液和FeCl3溶液反应存在一定的限度.请完成相关的实验步骤和现象.
可选试剂:①0.1mol?L-1KI溶液;②0.1mol?L-1?FeCl3溶液;③FeCl2溶液;④盐酸;⑤KSCN溶液;⑥CCl4.
实验步骤:
①取5mL?0.1mol?L-1?KI溶液,再滴加5~6滴0.1mol?L-1FeCl3溶液
②充分反应后,将溶液分成三份
③取其中一份,滴加试剂CCl4,用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘.
④另取一份,滴加试剂______,现象______,说明______.
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察______,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3?更为合理,其理由是______.
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中需要测量的数据是______.

参考答案:(1)④向含Fe3+的溶液中滴加几滴KSCN溶液呈血红色,这是Fe3+的特殊反应,所以可滴加KSCN溶液,溶液显血红色,就说明Fe3+没有反应完(或KI和FeCl3的反应有一定的限度).
故答案为:KSCN溶液;?溶液显血红色;?Fe3+没有反应完(或KI和FeCl3的反应有一定的限度).
(2)①2H2O2 =2H2O+O2 ↑,根据反应物和生成物的状态,可观察到的现象是气泡产生的快慢;为比较Fe3+和Cu2+对H2O2分解的催化效果,如果分别加入CuSO4和FeCl3,它们的阴阳离子都不同,所以无法判断是阴离子还是阳离子的影响,而Fe2(SO4)3?和CuSO4的阴离子相同,排除了阴离子的影响,所以能比较Fe3+和Cu2+对H2O2分解的催化效果.
故答案为:溶液中气泡产生的速率;排除氯离子的干扰(其它合理答案也给分);
②根据反应速率越大,单位时间内收集的气体越多,所以可测的物理量有气体的体积和时间.
故答案为:收集40mL气体所需的时间.
本题解析:
本题难度:一般
5、选择题 设C+CO2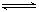 2CO-Q1(吸热反应)反应速率为 u1,N2+3H2 2CO-Q1(吸热反应)反应速率为 u1,N2+3H2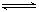 2NH3+Q2(放热反应)反应速率为 u2,对于上述反应,当温度升高时,u1和u2的变化情况为?(?) 2NH3+Q2(放热反应)反应速率为 u2,对于上述反应,当温度升高时,u1和u2的变化情况为?(?)
A.同 时增大
B.同 时减小
C.增大,减小
D.减小,增大
参考答案:A
本题解析:升高温度,化学反应速率加快,不管是正反映还是逆反应,故选A。
点评:本题考查的是影响化学反应速率的因素,题目很简单,只要学生熟悉各个因素对化学反应速率的影响就很容易解答本题。
本题难度:简单
|