1、选择题 在BaSO3(s)?Ba2+(aq)+SO32- (aq)平衡体系中,下列措施可使沉淀量减少的是( )
A.加入K2SO3(s)
B.加入稀HNO3
C.加入稀盐酸
D.加入K2SO4(s)
2、填空题 有甲、乙两同学做了如下实验:甲同学在制得的Mg(OH)2沉淀中加入浓的NH4Cl溶液,结果沉淀溶解;乙学生在制得的Mg(OH)2沉淀中加入浓的CH3COONH4溶液,结果沉淀也完全溶解。对此甲、乙两同学用学过的有关知识各自解释了上述实验事实:甲同学的解释为:因为NH4Cl溶液中,NH4++H2O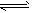 NH3·H2O+H+,且Mg(OH)2(s)
NH3·H2O+H+,且Mg(OH)2(s) Mg2++2OH-;又H++OH-=H2O,所以Mg(OH)2溶解平衡向右移动,促进
Mg2++2OH-;又H++OH-=H2O,所以Mg(OH)2溶解平衡向右移动,促进
Mg(OH)2的溶解。乙同学的解释为:因为NH4Cl=NH4++Cl-,CH3COONH4=CH3COO-+NH4+,且
Mg(OH)2(s) Mg2++2OH-;NH4++OH-=NH3·H2O,所以所以Mg(OH)2溶解平衡向右移动,促进
Mg2++2OH-;NH4++OH-=NH3·H2O,所以所以Mg(OH)2溶解平衡向右移动,促进
Mg(OH)2的溶解。你认为哪一位同学的解释是正确的?______________________________________________________________________________
3、填空题 (12分)氧化锌是重要的基础化工原料,从含锌废水(含Zn2+及少量的Mn2+、Fe2+及Pb2+等)为原料制取ZnO的实验流程如下:

已知几种难溶氢氧化物沉淀的PH范围
氢氧化物
| Fe(OH)3
| Fe(OH)2
| Zn(OH)2
| Pb(OH)2
|
pH
| 2.2~3.2
| 5.8~7.9
| 5.5~13.5
| 7.0~13.0
|
(1)KMnO4氧化废水中Mn2+生成MnO2的离子方程式为 ;滤渣I的主要成分除MnO2外,另一种
是 (写化学式)。
(2)滤渣II的主要成分除过量的Zn粉、MnO2外,还有 (写化学式);滤渣II中含有二氧化锰,其可能原因是 。
(3)灼烧生成的碱式碳酸锌[ZnCO3·2Zn(OH)2]的化学方程式为 ;灼烧时,用到的硅酸盐质仪器除酒精灯外还用到的2种是 。
4、选择题 已知常温下AgCl的Ksp=1.8×10-10,AgI的Ksp=8.5×10-17。若向5mL含有KCl和KI各为0.01mol/L的混合溶液中加入8mL 0.01mol/L AgNO3溶液,此时溶液中所含溶质的离子浓度大小关系正确的是
A.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-)
D.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-)
5、填空题 以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。

回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=________mol/L。
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=_________,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4 mol/L,c(ASO43-)最大为___________mol/L
(3)工厂排放出的酸性废水中的三价砷(H3ASO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷
(H3AsO4弱酸),写出该反应的离子方程式:__________________。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为_______________。
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为___________。