1、选择题 某原电池的总反应方程式为:2Fe3+ +Cu=== 2Fe2+ + Cu2+,能实现该反应的为( )
?
| A
| B
| C
| D
|
正极材料
| Cu
| 石墨
| Fe
| Ag
|
负极材料
| Fe
| Cu
| Cu
| Cu
|
电解质液
| CuSO4
| Fe2(SO4)3
| FeCl3
| AgNO3
参考答案:B
本题解析:根据总的反应式可知,铜失去电子,铁离子得到电子,所以原电池中负极材料是铜,正极材料是比铜不活泼的金属或石墨等,而电解质溶液中必须含有铁离子,例如硫酸铁等,答案选B。
点评:构成原电池的条件是活泼性不同的金属或金属和非金属,导线相连并插入到电解质溶液中,据此可以进行有关的判断。
本题难度:一般
2、填空题 (11分)设计燃料电池使汽油氧化直接产生电流,是本世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一个电极通入汽油蒸气,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。回答下列问题:
(1)以辛烷(C8H18)为汽油的代表物,则这个电池放电时必发生反应的化学方程式是 。
(2)这个电池负极的电极反应式为C8H18 + 25O2- =8CO2 + 9H2O +50e-,,正极的电极反应式为 ,固体电解质里O2-的移动方向是 。
(3)用此电池分别电解以下两种溶液,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,试回答下列问题。
①电解M(NO3)x溶液时某一电极增加了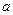 g M,则金属M的相对原子质量 g M,则金属M的相对原子质量
(用含“ 、x”的表达式表示)。 、x”的表达式表示)。
②电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100mL,阳极产生的气体在标准状况下的体积是 ;将电解后的溶液加水稀释至1L,此时溶液的c(H+)= 。
参考答案:(1)2C8H18 + 25O2 = 16CO2 + 18H2O (2)O2 + 4e- = 2O2-;由正极流向负极
(3)①ax/0.02 ②0.168L 0.01mol/L
本题解析:略
本题难度:简单
3、选择题 根据下图,下列判断中正确的是
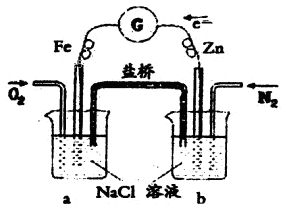
A.烧杯a中的溶液H+增大
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为:2H+ +2e-=H2
D.烧杯b中发生的反应为:2Cl--2e-=Cl2
参考答案:B
本题解析:A、不正确,O2+4H++4e― =2H2O,烧杯a中的溶液H+减小;B、正确,Zn―2e― =Zn2+ ,Zn被氧化;C、不正确,O2+4H++4e― =2H2O;D、不正确,Zn―2e― =Zn2+ ;选B。
本题难度:简单
4、选择题 如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显示红色。则以下说法正确的是
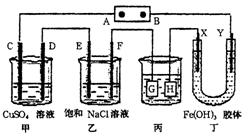
A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1﹕2﹕1﹕1
C.欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
参考答案:D
本题解析:略
本题难度:一般
5、选择题 分析如图所示的四个原电池装置,其中结论正确的是 ( )
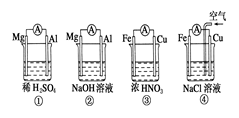
A.①②中Mg作为负极,③④中Fe作为负极
B.②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作为负极,电极反应为Fe-2e-===Fe2+
D.④中Cu作为正极,电极反应式为2H++2e-===H2↑
|
参考答案:B
本题解析:A错,①Mg作负极,②中Mg作正极,③中Fe作正极,④中Fe作负极;
B正确,②中Mg作为正极,电极反应式为6H2O+6e- ===6OH-+3H2↑;C错③中Fe作正极;D错,④中Cu作为正极,电极反应式为O2+4e-+2H2O===4OH—
本题难度:一般