1、选择题 对处于化学平衡的体系,关于化学平衡与化学反应速率的关系正确的是
[? ]
A.化学反应速率变化时,化学平衡一定发生移动
B.只有在催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况
C.正反应进行的程度大,正反应速率一定大
D.化学平衡发生移动时,化学反应速率一定变化
参考答案:D
本题解析:
本题难度:一般
2、填空题 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)已知反应N2(g)+O2(g) 2NO(g)?△H=+180KJ/mol 其他条件相同时,在不同的温度下分别发生该反应。已知1538℃时,NO的产率随时间变化如图所示,请补充完成2404℃时NO的产率随时间变化的示意图。
2NO(g)?△H=+180KJ/mol 其他条件相同时,在不同的温度下分别发生该反应。已知1538℃时,NO的产率随时间变化如图所示,请补充完成2404℃时NO的产率随时间变化的示意图。

(2)①2404℃时,反应N2(g)+O2(g) 2NO(g)的平衡常数为64,在容积为1.0L的密闭容器中通入2mol?N2和2mol?O2,计算反应N2(g)+O2(g)
2NO(g)的平衡常数为64,在容积为1.0L的密闭容器中通入2mol?N2和2mol?O2,计算反应N2(g)+O2(g) 2NO(g)达到平衡时N2的转化率。(此温度下不考虑O2与NO的反应。要求写出计算过程,计算结果保留两位有效数字)
2NO(g)达到平衡时N2的转化率。(此温度下不考虑O2与NO的反应。要求写出计算过程,计算结果保留两位有效数字)
②其他条件不变的情况下,将容器的体积压缩到原来的一半,对平衡体系产生的影响正确的是:________(填字母)。
A.c(N2)增大?
B.正反应速率加快,逆反应速率减慢
C.NO的物质的量增加?
D.重新平衡时c(N2)/?c(NO)不变
(3)在一定条件下,N2在催化剂表面与水反应,相应的热化学方程式如下:2N2(g)+6H2O(1)?=4NH3(g)+3O2(g)?△H=+1530kJ/mol?
则氨气与氧气催化氧化生成一氧化氮和水的热化学方程式为_____________________。
参考答案:(1) (2)①?设NO的平衡浓度为x
(2)①?设NO的平衡浓度为x N2的转化率为80%
N2的转化率为80%
②AD
(3)4NH3(g)+5O2(g)?=4NO(g)+6H2O(1)?△H=—1170?kJ·mol-1
本题解析:
本题难度:一般
3、选择题 可逆反应①X(g)+2Y(g) 2Z(g)、②2M(g)
2Z(g)、②2M(g) N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如下图所示
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如下图所示
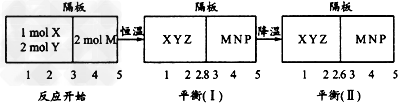
下列判断正确的是
[? ]
A.反应①的正反应是吸热反应
B.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C.达平衡(I)时,X的转化率为5/11
D.在平衡(I)和平衡(Ⅱ)中M的体积分数相等
参考答案:C
本题解析:
本题难度:一般
4、选择题 一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是
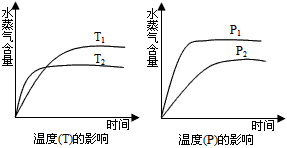
[? ]
A.CO2(g)+2NH3(g) === CO(NH2)2(s)+H2O;ΔH<0
B.CO2(g)+H2(g) === CO(g)+H2O(g) ;ΔH>0
C.CH3CH2OH(g) === CH2=CH2(g)+H2O(g) ;ΔH>0
D.2C6H5CH2CH3(g)+O2(g) === 2C6H5CH=CH2(g)+2H2O(g) ;ΔH<0
参考答案:A
本题解析:
本题难度:一般
5、填空题 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)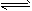 CH3OH(g),不同温度时甲醇的物质的量随时间变化曲线如下图所示。根据题意完成下列各题
CH3OH(g),不同温度时甲醇的物质的量随时间变化曲线如下图所示。根据题意完成下列各题
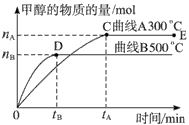
(1)反应达到平衡时,升高温度,v正_____________ (填“增大”“减小”或“不变”)。化学平衡向
_____________移动
(2)500 ℃,从反应开始到平衡,H2的反应速率v(H2)=________________________。
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是_____________。
A.氢气的浓度减小 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是__________________________(用化学方程式表示)。
参考答案:(1)增大;逆向
(2)2nB/3tB
(3)BC
(4)Cu2O+CO2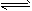 Cu+CO2(CO2能使平衡左移)
Cu+CO2(CO2能使平衡左移)
本题解析:
本题难度:一般