1、填空题 t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:
2SO2(g)+O2(g)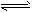 2SO3(g),△H=-196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物
2SO3(g),△H=-196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物
O2还乘余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为_______;平衡时SO2转化率为_________。
?(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同)_______________。
A.溶器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是__________。
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为_____________。
2、选择题 化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂:
HIn(溶液)?H+(溶液)+In-(溶液)
红色?黄色
浓度为0.02mol?L-1的下列各溶液:①盐酸?②石灰水?③NaCl溶液?④NaHSO4溶液?⑤NaHCO3溶液?⑥氨水,其中能使指示剂显红色的是( )
A.①④⑤
B.②⑤⑥
C.①④
D.②③⑥
3、填空题 科学家一直致力于“人工固氮”的新方法研究。
(1)目前合成氨技术原理为:N2(g)+3H2(g)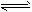 2NH3(g) △H=-92.4kJ/mol。
2NH3(g) △H=-92.4kJ/mol。
①673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
_________。

②在容积为2. 0L恒容的密闭容器中充入0.80mol N2(g)和1.60mol H2(g),反应在673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下反应N2(g)+3H2(g)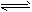 2NH3(g)的平衡常数K=____________。
2NH3(g)的平衡常数K=____________。
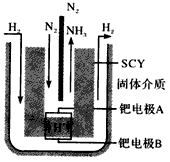
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨。其实验装置如图阴极的电极反应式___________________。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(l)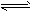 2NH3(g)+3/2O2(g) △H=akJ/mol进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
2NH3(g)+3/2O2(g) △H=akJ/mol进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
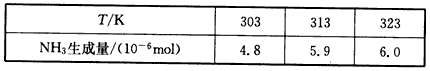
①此合成反应的a______0;△S_____0,(填“>”、“<”或“=”)
②已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol 2H2(g)+O2(g)=2H2O(l) △H=-571. 6kJ/mol
2NH3(g) △H=-92.4kJ/mol 2H2(g)+O2(g)=2H2O(l) △H=-571. 6kJ/mol
则N2(g)+3H2O(l)=2NH3(g)+3/2O2(g) △H=__________kJ/mol
4、选择题 对于平衡体系xA(气)+yB(固) mC(气)+nD(气),其它条件不变,增大压强,C的百分含量减少,则明下列关系中正确的是
mC(气)+nD(气),其它条件不变,增大压强,C的百分含量减少,则明下列关系中正确的是
[? ]
A.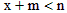
B.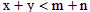
C.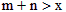
D.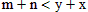
5、填空题 一密闭容器中发生下列反应:N2(g)+3H2(g) 2NH3(g);ΔH<0下图是某一时间段中反应速率与反应进程的曲线关系图。回答下列问
2NH3(g);ΔH<0下图是某一时间段中反应速率与反应进程的曲线关系图。回答下列问

(1)t1.t3.t4时刻,体系中分别是什么条件发生了变化?
t1___________________ t3___________________ t4____________________.
(2)下列时间段中,氨的百分含量最高的是_________.
A.t0~t1
B.t2~t3
C.t3~t4
D.t5~t6