1、选择题 X、Y、Z、W、R均是短周期元素,它们在元素周期表中的相对位置如图所示,其中W的最高正化合价与最低负化合价绝对值相等。下列说法正确的是(?)
?
A.X、Y形成的某种化合物可作为呼吸面具中X2的来源
B.气态氢化物的热稳定性:HmX>HmR>WHn
C.Z、W、R分别与X形成的化合物的水化物都是强酸
D.化合物YaX和YaR中,阳离子半径均大于阴离子半径
参考答案:AB
本题解析:短周期中“最高正化合价与最低负化合价绝对值相等”的元素是碳元素或硅元素,根据各种元素在周期表中的位置关系可以知道,W为Si,故X为O、R为S、Y为Na、Z为Al。铝元素形成的酸是两性氢氧化物,C选项错误;在Na2S中,r(Na2+)小于r(S2-),D选项错误。
本题难度:一般
2、选择题 元素X和元素Y在周期表中位于相邻的两个周期,X和Y两原子核外电子总数之和为19,Y原子核内质子数比X多3个,下列叙述正确的是
A.X和Y都是性质活泼的元素,在自然界中只能以化合态存在
B.X和Y形成的化合物的化学式为Y2X
C.X的最高正价为+6
D.Y能置换酸中氢,放出氢气,但不能置换出盐中的金属
参考答案:B
本题解析:
由于X、Y两原子核外电子总数之和为19,故二者为短周期元素,设X的原子序数为x,则Y的原子序数就为x+3,由x+x+3=19,可得x=8,Y为11,故X为O元素,Y为Na元素。显然选项A项不正确;Na与O能形成Na2O,故B项正确;故X为O元素,其最高价不可能有+6,一般是-2价,C项不正确;Na只能与非氧化性的酸反应时,都能放出氢气,与氧化性的酸发生的是氧化还原反应,不是置换反应,故D项不正确。本题选B。
本题难度:一般
3、填空题 有机物A~F之间的转化关系如下图所示(部分产物已略去),其中B的相对分子质量是D的2倍。

提示: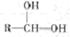 会自动脱水形成R—CHO
会自动脱水形成R—CHO
根据以上信息回答下列问题:
(1)B的分子式是?
(2)检验D中官能团可使用的试剂名称是?,写出D的相邻同系物与该试剂反应的化学方程式_______________________________。
(3)C遇FeCl3溶液显紫色,核磁共振氢谱中有四个峰,其峰面积比为1:2:2:1。写出C的结构简式_______________________。
(4)写出符合下列条件的C的同分异构体的结构简式_______、______、______、________。
①苯环上存在对位取代基;②遇FeCl3溶液显紫色;
③能与银氨溶液反应。
(5)写出A的结构简式__________________________。
(6)若1molA 和足量NaOH反应,最多能消耗___________mol NaOH。
和足量NaOH反应,最多能消耗___________mol NaOH。
参考答案: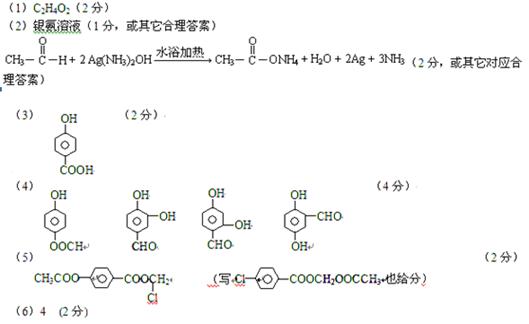
本题解析:略
本题难度:一般
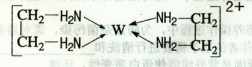
4、选择题 【化学——选修3:物质结构与性质】(15分)X、Y、Z、V、W为五种前四周期元素,其中X是短周期(除稀有气体外)原子半径最大的元素;Y与X同周期,其最高价氧化物的水化物呈两性;Z原子基态时2p原子轨道上有3个未成对的电子;V原子的核外电子排布式为ls22s22p63s2;W的原子序数为29,W的离子能与乙二胺(H2N—CH2一CH2一NH2)形成配离子:
回答下列问题:
(1)W原子的核外电子排布式为?,该配离子中含有的化学键类型有?。(填字母)
a.配位键? b.极性键? c.离子键? d.非极性键
(2)元素X、Y、V第一电离能由大到小的顺序是?(用元素符号表示)。
(3)Z的氢化物的空间构型是?;该氢化物的沸点比甲烷的高,其主要原因是?;Z的另一种氢化物Z2H4分子中Z原子轨道的杂化类型是?。
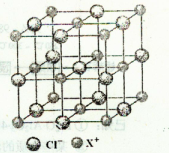
(4)X和Cl元素构成的化合物XCl,XCl的晶胞结构如右图所示,晶体中X+的配位数是?;每个X+周围与其紧邻的Cl-围成的几何图形为?。
参考答案:(1)[Ar]3d104s1(或1s22s22p63s23p63d104s1)(2分);abd(2分)
(2)Mg>Al>Na(2分)
(3)三角锥形(2分);氨分子间存在氢键(2分);sp3(2分)。
(4)6(1分);正八面体(2分)
本题解析:本题考查元素推断及物质结构的有关知识。由“X是短周期(除稀有气体外)原子半径最大的元素”可确定X是钠;“Y与X同周期,其最高价氧化物的水化物呈两性” 可确定Y是Al;由“Z原子基态时2p原子轨道上有3个未成对的电子”可确定Z是N;由“V原子的核外电子排布式为ls22s22p63s2”可确定V是Mg;由“W的原子序数为29”可确定W是Cu。
(1)W原子的核外电子排布式为[Ar]3d104s1(或1s22s22p63s23p63d104s1),该配离子中含有的化学键类型有配位键(Cu、N之间)、极性键(N、H与C、H之间)、非极性键(C、C之间),故选abd。(2)由于Mg存在3p全空特例,Mg的第一电离能比相邻元素都高,同周期,随原子序数增大,元素原子的第一电离能有增大的趋势,故Na、Mg、Al第一电离能由大到小的顺序是Mg>Al>Na。(3)NH3中N采用sp3杂化,与H结合形成三角锥形,由于N半径小,电负性大,分子间可形成氢键,使NH3的沸点比CH4高,N的另一种氢化物N2H4分子中N原子轨道的杂化类型也是sp3杂化,分别N、H形成共价键。(4)从NaCl?的晶体结构可以看出,晶体中Na+的配位数是6(前后左右上下各一个Cl-)。每个Na+周围与其紧邻的Cl-围成的几何图形为正八面体(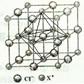 )。
)。
本题难度:一般
5、计算题 将10.0 mL适量AlCl3溶液滴入10.0 mL 1.20 moL·L-1的NaOH溶液中,不断振荡,反应完全沉淀恰达最大值。问:?
(1)最多可得沉淀多少克??
(2)最后所得溶液中的溶质是什么?溶液浓度是多少?(假设体积具有加和性)
参考答案:(1)0.312 g (2)NaCl 0.600 mol·L-1。
本题解析:(1)?n?(NaOH)="0.010" 0 L×1.20 mol·L-1=1.20×10-2 mol
①AlCl3+4NaOH====NaAlO2+3NaCl+2H2O
3NaAlO2+AlCl3+H2O====4Al(OH)3↓+3NaCl
当沉淀达最大值时,相当于:
AlCl3+3NaOH====Al(OH)3↓+3NaCl
?n〔Al(OH)3〕=n(NaOH)×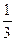 =1.20×10-2mol×
=1.20×10-2mol×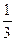 =4.00×10-3 mol
=4.00×10-3 mol
?m〔Al(OH)3〕="78.0" g· mol-1×4.00×10-3 mol="0.312" g
(2)由①反应知,所得溶液中溶质是NaCl,
?n(NaCl)=n(NaOH)=1.20×10-2 mol(Na原子守恒)
?c(NaCl)=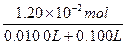 ="0.600" mol·L-1?
="0.600" mol·L-1?
本题难度:简单