1、选择题 以下关于下图说法正确的是

A.如图表明催化剂可以改变反应的热效应
B.如图表示某反应能量的变化与生成物状态无关
C.如图表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.如图表明化学反应不仅遵循质量守恒定律,也遵循能量守恒
参考答案:D
本题解析:A.催化剂不能改变反应的热效应,只能改变反应的活化能,错误。B.反应能量的变化与生成物状态及量都有关系,错误。C.右图表示的是放热反应,错误。D.右图表明化学反应不仅遵循质量守恒定律,也遵循能量守恒,正确。
本题难度:一般
2、选择题 下列说法中正确的是
[? ]
A、在化学反应过程中,发生物质变化的同时不一定发生能量变化
B、生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 C、生成物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D、ΔH的大小与热化学方程式的计量系数无关
参考答案:C
本题解析:
本题难度:一般
3、填空题 工业上在催化剂作用下可利用CO合成甲醇:CO(g)+2H2(g) CH3OH(g),图1表示反应过程中能量的变化情况。
CH3OH(g),图1表示反应过程中能量的变化情况。
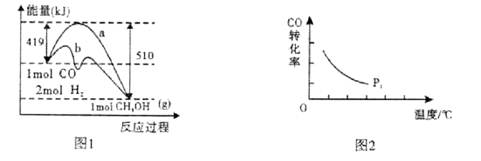
请回答下列问题:
(1)在图I中,曲线______(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)为探究外界条件对合成甲醇化学反应速率的影响规律,某科技工作者设计了以下三组实验,部分数据已填人表中,请补充完整。
实验组
| T/℃
| 起始浓度/mol?L-1
| 等质量催化剂的
比表面积/m2?g-1
|
CO
| H2
|
①
| 280
| 1.20×10-3
| 5.80×10-3
| 82
|
②
| 280
| 1.20×10-3
| 5.80×10-3
| 124
|
③
| 350
| ?
| ?
| 124
|
?
其中设计实验组①和②的目的是______。
(3)“图2”所揭示的规律是:在p1压强达平衡时______;并请画出在p2压强下(p2> p1)的曲线。
(4)在碱性条件下可将合成甲醇的反应设计成原电池,则负极的电极反应式为______。
参考答案:(15分)
(1)b(2分)?放热(2分)
(2)1.20×10-3(1分)? 5.80×10-3(1分)?探究等质量催化剂的比表面积不同时对合成甲醇化学反应速率的影响规律(2分,其它合理答案也给分)
(3)CO的转化率随温度的升高而降低(2分)

(4)H2 —2e-+2OH-=2H2O(3分)
本题解析:(1)读图1,催化剂能降低反应的活化能,曲线a代表正或逆反应的活化能高于曲线b,所以b表示使用了催化剂,a表示未使用催化剂;放热反应中反应物总能量高于生成物总能量,吸热反应中反应物总能量低于生成物总能量,图中1molCO和2molH2的总能量高于1molCH3OH(g)的总能量,所以该反应是放热反应,△H=—91kJ/mol;(2)只改变一个变量进行探究,才能更快得外界条件影响化学反应速率的规律,这是设计实验的基本原则,实验②③的温度分别是280℃、350℃,则CO和H2的起始浓度、等质量催化剂的比表面积都应该相同,所以CO和H2的起始浓度分别为1.20×10-3mol/L、5.80×10-3mol/L;实验①②的温度、CO和H2的起始浓度都相同,等质量催化剂的比表面积分别为82m2/g、124m2/g,所以这组实验的目的是探究等质量催化剂的比表面积不同时对合成甲醇化学反应速率的影响规律;(3)读图2,横纵坐标分别表示温度、CO转化率,当压强不变时,曲线表示CO的转化率随温度升高而降低;当温度不变时,由于正反应是气体体积减小的反应,增大压强平衡向正反应方向移动,CO的平衡转化率增大,由此推断p2时曲线高于p1时曲线;(4)反应CO(g)+2H2(g) CH3OH(g)中出碳元素由+2降为—2,氢元素由0升为+1,说明CO得到电子,发生还原反应,而H2失去电子,发生氧化反应,因此负极的主要反应物和产物是氢气和水,由此先得出H2 —2e-→H2O;碱性条件下只能用氢氧根离子使左右电荷守恒,则H2 —2e-+2OH-→H2O;电极反应式遵循质量守恒定律,根据氢、氧原子个数守恒,则该电池负极反应式为H2 —2e-+2OH-=2H2O。
CH3OH(g)中出碳元素由+2降为—2,氢元素由0升为+1,说明CO得到电子,发生还原反应,而H2失去电子,发生氧化反应,因此负极的主要反应物和产物是氢气和水,由此先得出H2 —2e-→H2O;碱性条件下只能用氢氧根离子使左右电荷守恒,则H2 —2e-+2OH-→H2O;电极反应式遵循质量守恒定律,根据氢、氧原子个数守恒,则该电池负极反应式为H2 —2e-+2OH-=2H2O。
本题难度:困难
4、选择题 下列叙述正确的是( )
A.物质燃烧不一定是放热反应
B.放热反应不需要从外界吸收任何能量就能发生
C.化学反应的实质是共价键的断裂和共价键的生成
D.化学反应除了生成新的物质外,还常伴随着能量的变化
参考答案:A.燃烧反应一定为放热反应,故A错误;
B.放热反应也可能需要外界能量引发反应,如氢气燃烧需要点燃等,故B错误;
C.化学反应的实质为旧键断裂、新键形成,则化学反应中可能有离子键、共价键的断裂和生成,故C错误;
D.化学反应中既有物质变化,又有能量变化,所以化学反应除了生成新的物质外,还常伴随着能量的变化,故D正确;
故选D.
本题解析:
本题难度:一般
5、选择题 工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.4kJ/mol,下列判断正确的是( )
A.反应物能量总和大于生成物能量总和
B.CO(g)+H2(g)=C(s)+H2O(l)△H=-131.4?kJ/mol
C.生产水煤气反应中,生成1L?H2(g)时吸收131.4?KJ的热量
D.有NA个H-H键形成时吸收131.4?KJ的热量
参考答案:A、反应是吸热反应,证明反应物能量低于生成物能量,故A错误;
B、反应中是液态水,根据题干热化学方程式判断CO(g)+H2(g)=C(s)+H2O(1)△H<-131.4 kJ/mol,故B错误;
C、温度和压强不知,1L氢气物质的量不是1mol,故C错误;
D、有NA个H-H键形成时,即生成1mol氢气,依据热化学方程式判断,吸收131.4 KJ的热量,故D正确;
故选D.
本题解析:
本题难度:一般