1、选择题 已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列系正确的是
A.离子的还原性:Y2->Z-
B.质子数:c>b
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W
参考答案:A
本题解析:略
本题难度:简单
2、选择题 下列各项叙述中,正确的是
A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B.价电子排布为5s25p1的元素位于第五周期第ⅠA族,是S区元素
C.所有原子任一能层的S电子云轮廓图都是球形,但球的半径大小不同
D.24Cr原子的电子排布式是:1s22s22p63s23p63d44s2
参考答案:C
本题解析:原子由基态转化成激发态,要吸收能量,A不正确。B不正确,应该是位于第ⅢA,属于p区元素。电子出全充满或半充满是稳定的,所以24Cr原子的电子排布式是:1s22s22p63s23p63d54s1,D不正确。所以正确的答案是C。
本题难度:一般
3、选择题 据报道,元素钬有一种放射性核素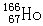 可有效治疗肝癌。该核素原子核内的中子数为
可有效治疗肝癌。该核素原子核内的中子数为
A.67
B.99
C.166
D.233
参考答案:B
本题解析:中子数+质子数=质量数,所以该原子核内中子数=166-67=99,答案选B。
点评:该题是高考中的常见题型,属于基础性试题的考查,该题的关键是记住中子数、质子数和质量数的关系,然后灵活运用即可,学生很易得分。
本题难度:简单
4、填空题 (每空2分,共14分)根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图为:__________。
(2)写出3p轨道上有2个未成对电子的元素的符号:_____________。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是_________。
(4)根据VSEPR模型,H3O+的分子立体结构为:?,SO2的立体结构为:?。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为?;若两种晶体中最邻近的铁原子间距离相同,则体心立方晶胞和面心立方晶胞的密度之比为?。
参考答案:(1) ?(2)S或Si?(3)硒?(4)三角锥形、V形?
?(2)S或Si?(3)硒?(4)三角锥形、V形?
(5) 1∶2?;? 3 /8
/8
本题解析:(1)原子序数最小的第Ⅷ族元素是铁元素,原子序数是26,其结构示意图为 。
。
(2)根据构造原理可知,3p轨道上有2个未成对电子的元素可以是硫元素,也可以是硅元素。
(3)根据构造原理并原子的外围电子排布式,可判断,该元素是第四周期第ⅥA的硒元素。
(4)H3O+的分子中心原子的孤对电子是(6-1-1×3)2=1,即含有1对孤对电子。所以是三角锥形。SO2中中心原子的孤对电子是(6-2×2)1=1,即含有1对孤对电子。所以是V形结构。
(5)根据晶胞的结构可知,体心立方晶胞含有的铁原子是8×1/8+1=2,面心立方晶胞中含有的铁原子是8×1/8+6×1/2=4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1∶2。设最邻近的铁原子的半径a,则体心立方晶胞中有 ,而面心立方晶胞中有
,而面心立方晶胞中有 ,所以二者的密度之比是3
,所以二者的密度之比是3 /8。
/8。
本题难度:一般
5、选择题 X、Y是同主族的非金属元素,如果X原子半径比Y原子大,则下列说法错误的是(?)
A.X的非金属性比Y弱
B.X的原子序数比Y的小
C.x的气态氢化物比Y的气态氢化物稳定
D.x的最高价氧化物对应的水化物的酸性比Y的最高价氧化物对应的水化物的酸性弱
参考答案:BC
本题解析:略
本题难度:简单