1、填空题 M原子在第二能层上只有一个空轨道,则M是?;其电子排布式为?;R原子的3p轨道上只有一个未成对电子,则R原子可能是?、?;Y原子的核电荷数为33,其外围电子排布是?,其在元素周期表中的位置是?,是属于?区的元素。
参考答案:C? 1s22s22p2?Al? Cl? 4s24p3?第四周期第ⅤA族? P区
本题解析:M原子在第二能层上只有一个空轨道,则M的核外电子排布式是1s22s22p2.则M是C元素。R原子的3p轨道上只有一个未成对电子,则R的核外电子排布式是1s22s22p63s23p1或1s22s22p63s23p5.则该元素可能是13号元素Al或17号元素Cl.。Y原子的核电荷数为33.根据原子核外电子排布的能级图可知:其核外电子排布式是1s22s22p63s23p63d104s24p3;其外围电子排布是4s24p3.该元素在元素周期表中的位置是位于第四周期第ⅤA族,是P区的元素。
本题难度:一般
2、选择题 下列关于碱金属元素的原子结构和性质的叙述不正确的是
A.碱金属原子最外层都只有1个电子,在化学反应中容易失去
B.碱金属单质都是强还原剂
C.碱金属单质都能在氧气中燃烧生成过氧化物
D.碱金属单质都能与水反应生成强碱
参考答案:C
本题解析:碱金属自上而下,金属性逐渐增强,但在氧气中燃烧的生成物是不同的,例如Li生成Li2O,钠生成Na2O2,选项C不正确,其余选项都是正确的,答案选C。
点评:该题是高考中的常见考点,属于中等难度的试题。试题紧扣教材基础,旨在培养学生灵活运用元素周期律解决实际问题的能力,有利于调动学生的学习兴趣,增强学生的学习自信心。
本题难度:一般
3、选择题 下列说法正确的是(?)
A.元素周期表每一周期元素原子的最外层电子排布均是从ns1 过渡到ns2np6
B.原子核外电子排布为1s1的原子与原子核外电子排布为1s22s1的原子的化学性质相似
C.所有的非金属元素都分布在p区
D.手性催化剂只催化或者主要催化一种手性分子的合成
参考答案:D
本题解析:元素周期表前三周期原子的最外层电子排布均是从ns1 过渡到ns2np6,从第四周期开始最外层存在d轨道和f轨道,A错误;1s1的原子是氢原子,为1s22s1的原子是锂原子二者性质相差较大,B错误;氢元素属于非金属元素但是氢元素在s区,C错误;手性催化剂是一种特定的催化剂,只使反应向着一种手性分子生成的方向进行,所以答案选D。
本题难度:一般
4、填空题 A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4∶1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2∶1的离子化合物丙。
(1)D的原子结构示意图为? ________?,丙的电子式为___________?,E在周期表中的位置为?。
(2)下列说法正确的有?。
①化合物乙分子中只含有极性共价键
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物更稳定
④化合物甲和化合物丙都含有离子键和共价键
(3)将F燃烧的产物通入BaCl2和HNO3的混合溶液中,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应? __________________?。
(4)写出一个由以上元素构成的10电子微粒与18电子微粒反应的离子方程式? ____________________________?。
(5)甲溶液显?(填“酸性”、“碱性”或“中性”),原因是?(用离子方程式表示)。
参考答案:(1)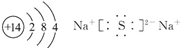 ?第三周期第ⅤA族? (2)①②③
?第三周期第ⅤA族? (2)①②③
(3)3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+
(4)2NH3+H2S=2NH4++S2-或NH3+HS-=NH4++S2-或NH3+H2S=NH4++HS-
(5)酸性? NH4++H2O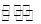 NH3·H2O+H+
NH3·H2O+H+
本题解析:A是原子半径最小的元素,A为H;B的最高价氧化物的水化物与其氢化物可以反应生成离子化合物甲,B为N,甲为NH4NO3;E与B同主族,E为P;A与D按照4∶1形成化合物乙,乙分子中含有18个电子,D为Si,乙为SiH4;F的原子序数比P大,且F的阴离子与C的阳离子差一个电子层,C与F都在第三周期,F可能为S或Cl,C与F能按照2∶1形成离子化合物丙,C只能为Na,F为S,丙为Na2S。
(1)Si的原子结构示意图为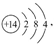 Na2S的电子式为
Na2S的电子式为 P在元素周期表中的位置为第三周期第ⅤA族。
P在元素周期表中的位置为第三周期第ⅤA族。
(2)SiH4分子中只含有极性共价键,①对;Na、Si、P、S的原子半径按照原子序数递增的顺序依次减小,所以原子半径Na>Si>P>S,②对;N的非金属性大于P,NH3的稳定性大于PH3,③对;NH4NO3中含有共价键和离子键,Na2S中只含有离子键,④错。
(3)SO2通入BaCl2和HNO3的混合溶液中,HNO3将SO2氧化为SO42-,NO3-本身被还原为NO,SO42-与Ba2+结合生成白色沉淀,反应的离子方程式为3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+。
(4)以上元素组成的10电子微粒有NH3、Na+、NH4+;18电子微粒有SiH4、PH3、H2S、HS-、S2-。能相互反应的有2NH3+H2S=2NH4++S2-或NH3+HS-=NH4++S2-或NH3+H2S=NH4++HS-。
(5)NH4NO3溶液显酸性,原因是NH4+发生水解反应NH4++H2O NH3·H2O+H+
NH3·H2O+H+
本题难度:一般
5、填空题 (12分)【化学—物质结构与性质】
已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大。G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于分子晶体;在元素周期表中Z元素位于第11列。
回答下列问题:
(1)Z+的核外外围电子排布式是_________________________________________________。
(2)X以及与X左右相邻的两种元素,其第一电离能由由大到小的顺序为____________(填元素符号)。
(3)Q元素最高价氧化物的水化物分子中,Q原子采取________杂化,写出与QR2互为等电子体的一种分子的化学式:____________________。
(4)分子式为G 2R、G 2Y的两种物质中一种更稳定,原因是________________________;Q的氯化物、T的氯化物、X的氯化物的熔点由低到高的顺序是___(填化学式)。
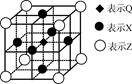
(5)据报道,由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如下图所示。晶体中距每个X原子周围距离最近的Q原子有?个
参考答案:(1) 3d10 (2分)
(2) Mg> Al > Na (2分)
(3) sp2 N2O(或CS2等)(各1分)
(4) O的非金属性比S强(或H2O的键能比H2S大)(2分)? CCl4 < NaCl < MgCl2? (2分)
(5) 2(2分)
本题解析:根据G阴离子的电子数判断,G是H元素;依据Q原子的电子排布,Q是C碳元素;Z原子最外层电子数为2, Z是第11列,在ⅠB族,是Cu元素;Y原子基态3p原子轨道上(在第三周期)有2个未成对电子,则是3p2或3p4,若是前者,Y是Si元素,其单质不是分子晶体,故Y是S元素;T2R的晶体类型是离子晶体,T是+1价阳离子,R是-2价阴离子,R是O,则T是Na;X元素最外层电子数与最内层电子数相同,X是Mg元素。
(1) Cu原子电子排布要符合洪特规则,3d轨道半充满时更稳定,所以Cu原子外围电子排布式为:3d104s1,则Cu+的外围电子排布式为:3d10
(2) Mg的3s2处于全满状态,第一电离能比其左右都大,所以第一电离能由大到小的顺序为:Mg> Al > Na。
(3) Q元素最高价氧化物的水化物为H2CO3,中心原子C形成了3个σ键,所以C原子为sp2杂化;原子数目和价电子数目相等的微粒为等电子体,所以QR2即CO2的等电子体分子为:N2O(或CS2等)。
(4) O的非金属性强于S,故H2O比H2S稳定;Q、T、X的固态氯化物分别为CCl4、NaCl、MgCl2,NaCl和 MgCl2属于离子晶体,CCl4属于分子晶体,离子晶体的熔点一般高于分子晶体,Mg2+电荷大于Na+,离子半径Mg2+小于Na+,所以MgCl2晶体的晶格能大于NaCl晶体的晶格能,所以这三种物质的熔点由低到高的顺序是CCl4 < NaCl < MgCl2
(5)利用均摊法确定Q原子个数,每个X原子被两个晶胞共用,每个晶胞含有一个Q原子,所以晶体中距每个X原子周围距离最近的Q原子有2个。
本题难度:一般