1、选择题 元素R有如下反应:RO3—+5R-+6H+===3R2+3H2O,下列说法正确的是(?)
A.元素R位于周期表中第ⅤA族
B.RO3—中的R只能被还原
C.每反应消耗1 mol RO3—,转移电子的物质的量为5 mol
D.R2在常温常压下一定是气体
参考答案:C
本题解析:根据反应式可知,R的最低价是-1价,所以最高价是+7价,即R是第ⅦA元素。RO中的R化合价是+5价,处于中间价态,既能被还原,也能被氧化。单质也可能是溴,所以只有选项C是正确的,答案选C。
本题难度:简单
2、选择题 X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
A.原子半径:Z>Y>X
B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点
C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂
D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1︰2
参考答案:B
本题解析:Ca2+的核外电子数为18,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构说明X、Z能形成负1价离子,故X为H、Z为F,而X不可能为F、Z不可能为Cl;由此可进一步推出Y为O。原子半径:O>F>H,A项错误;HF分子间存在氢键,故其沸点是同主族元素氢化物中最高的,B项正确;CaO2与水发生反应时,O22-歧化,既作氧化剂,又作还原剂,C项错误;CaO2中的阳离子与阴离子个数比均为1:1,D项错误。
【考点定位】本题考查短周期元素的性质推断和元素周期表知识。
本题难度:一般
3、填空题 (7分).下图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍。
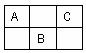
1、(用元素符号表示)A?B?C?
2、B的最高价氧化物的化学式?,属于?晶体。
3、C的气态氢化物的化学式?,其中存在?键。
参考答案:(7分)? N? S? F? SO3?分子? HF?共价
本题解析:略
本题难度:一般
4、选择题 下列根据元素周期律做出的推断正确的是
A.Na、Mg、Al的还原性依次增强
B.HF、HCl、HBr的稳定性依次增强
C.H3PO4、H2SO4、HClO4的酸性依次增强
D.NaOH、KOH、CsOH的碱性依次减弱
参考答案:C
本题解析:同周期自左向右,金属性逐渐减弱,非金属性逐渐增强,最高价氧化物的水化物的酸性逐渐增强,A不正确,C正确。同主族自上而下金属性逐渐增强,最高价氧化物的水化物的碱性逐渐增强,非金属性逐渐减弱,相应氢化物的稳定性逐渐减弱,所以BD都是错误的,答案选C。
本题难度:简单
5、选择题 下列说法中正确的是
A.1mol FeCl3转化成氢氧化铁胶体后,生成NA个氢氧化铁胶体微粒
B.丁达尔效应是溶液和胶体的本质区别
C.在Fe(OH)3胶体中插入两个石墨电极,通直流电,阴极附近液体颜色变深
D.纳米材料微粒直径一般从几纳米到几十纳米,因此纳米材料属于胶体
参考答案:C
本题解析:分析:A、胶体微粒是氢氧化铁的集合体;
B、分散系的本质区别是微粒直径大小;
C、氢氧化铁胶体吸附带正电的离子,通电移向阴极;
D、纳米材料微粒直径一般从几纳米到几十纳米是分散质;
解答:A、胶体微粒是氢氧化铁的集合体,1mol FeCl3转化成氢氧化铁胶体后,生成氢氧化铁胶体微粒小于NA个,故A错误;
B、丁达尔效应是溶液和胶体的鉴别方法,分散质微粒直径的大小是本质区别,故B错误;
C、氧化铁胶体吸附带正电的离子,通电移向阴极,发生电泳现象,故C正确;
D、纳米材料微粒直径一般从几纳米到几十纳米是分散质,在分散剂中形成胶体混合物,故D错误;
故选C.
点评:本题考查了胶体性质应用,本质区别,胶体微粒的吸附作用和电泳现象的分析判断,较简单.
本题难度:一般