1ЎўјтҙрМв БӘ°ұЈЁN2H4Ј©ј°ЖдСЬЙъОпКЗТ»АаЦШТӘөД»рјэИјБПЈ®N2H4УлN204·ҙУҰДЬ·ЕіцҙуБҝөДИИЈ®
ЈЁ1Ј©ТСЦӘЈә2N02ЈЁgЈ©ЁTN204ЈЁgЈ©ЎчH=Т»57.20kJ?mol-Ј®Т»¶ЁОВ¶ИПВЈ¬ФЪГЬұХИЭЖчЦР·ҙУҰ2N02ЈЁgЈ©?
?N204ЈЁgЈ©ҙпөҪЖҪәвЈ®ЖдЛыМхјюІ»ұдКұЈ¬ПВБРҙлК©ДЬМбёЯNOzЧӘ»ҜВКөДКЗ______ЈЁМоЧЦДёЈ©
AЈ®јхРЎN02өДЕЁ¶И?BЈ®ҪөөНОВ¶И?CЈ®ФцјУN02өДЕЁ¶И?DЈ®ЙэёЯОВ¶И
ЈЁ2Ј©17ЎжЎў1.0IЎБ105PaЈ¬2LГЬұХИЭЖчЦРN204әНN02өД»мәПЖшМеҙпөҪЖҪәвКұЈ¬ҙжФЪOЈ®0600molN02Ј¬0.0240mol?N204Ј®ФтҙЛ·ҙУҰ2N02ЈЁgЈ©
N204ЈЁgЈ©өДЖҪәвіЈКэK______Ј»
ИфјхЙЩИЭЖчМе»эЈ¬ФтЖҪәвіЈКэK______ЈЁМоЎ°ФцҙуЎұЎўЎ°јхРЎЎұ»тЎ°І»ұдЎұЈ©Ј®
ИфЙэёЯМеПөОВ¶ИЈ¬ФтЖҪәвіЈКэK______ЈЁМоЎ°ФцҙуЎұЎўЎ°јхРЎЎұ»тЎ°І»ұдЎұЈ©Ј®
ІОҝјҙр°ёЈәЈЁ1Ј©ёГ·ҙУҰКЗ·ҙУҰЗ°әуЖшМеМе»эјхРЎөДЎў·ЕИИөДҝЙДж·ҙУҰЈ¬ТӘК№ёГ·ҙУҰПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬ҝЙёДұд·ҙУҰОпөДЕЁ¶ИЎўМеПөөДС№ЗҝЎўОВ¶ИөИЈ®
AЎўјхРЎN02өДЕЁ¶ИЈ¬ЖҪәвПтДж·ҙУҰ·ҪПтТЖ¶ҜЈ¬N02өДЧӘ»ҜВКҪөөНЈ¬№КAҙнОуЈ»
BЈ®ҪөөНОВ¶ИЈ¬ЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬N02өДЧӘ»ҜВКМбёЯЈ¬№КBХэИ·Ј»
CЈ®ФцјУN02өДЕЁ¶ИЈ¬ЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬ЗТМеПөС№ЗҝФцҙуЈ¬ТІАыУЪ·ҙУҰПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬№КCХэИ·Ј»
DЈ®ЙэёЯОВ¶ИЈ¬ЖҪәвПтДж·ҙУҰ·ҪПтТЖ¶ҜЈ¬N02өДЧӘ»ҜВКҪөөНЈ¬№КDҙнОуЈ»
№Кҙр°ёОӘЈәBCЈ»
ЈЁ2Ј©CЈЁNO2Ј©=OЈ®0600mol2L=0.0300 mol/LЈ¬CЈЁN2O4Ј©=0.0240mol?2L=0.0120mol/LЈ»
K=C(N204)C(NO2)2=0.01200.0300?ЎБ0.0300?=13.3Ј¬
ИфјхЙЩИЭЖчМе»эЈ¬МеПөС№ЗҝФцҙуЈ¬ЖҪәвПтХэ·ҙУҰ·ҪПтТЖ¶ҜЈ¬ө«»ҜС§ЖҪәвіЈКэІ»ұдЈ¬
ИфЙэёЯМеПөОВ¶ИЈ¬ЖҪәвПтДж·ҙУҰ·ҪПтТЖ¶ҜЈ¬CЈЁNO2Ј©ФцҙуЈ¬ФтЖҪәвіЈКэKјхРЎЈ¬
№Кҙр°ёОӘЈә13.3Ј»І»ұдЈ»јхРЎЈ®
ұҫМвҪвОцЈә
ұҫМвДС¶ИЈәТ»°г
2ЎўМоҝХМв ЈЁ1Ј©ОӘМҪҫҝУГCO2АҙЙъІъИјБПјЧҙјөД·ҙУҰФӯАнЈ¬ПЦҪшРРИзПВКөСйЈәФЪМе»эОӘ1LөДГЬұХИЭЖчЦРЈ¬ідИл1mol
CO2әН3molH2Ј¬Т»¶ЁМхјюПВ·ўЙъ·ҙУҰЈәCO2(g)+3H2(g)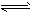 CH3OH(g)+H2O(g) ЎчH=-49.0kJ/mol ІвөГCO2әН
CH3OH(g)+H2O(g) ЎчH=-49.0kJ/mol ІвөГCO2әН
CH3OHЈЁgЈ©өДЕЁ¶ИЛжКұјдұд»ҜИзНјЎЈЗл»Шҙр
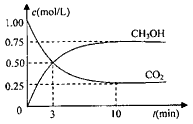
ўЩ ҙУ·ҙУҰҝӘКјөҪЖҪәвЈ¬ЗвЖшөДЖҪҫщ·ҙУҰЛЩВКЈәv(H2)=________mol/ЈЁLЎӨminЈ©ЎЈ
ўЪЙэёЯОВ¶ИЈ¬ёГ·ҙУҰөДЖҪәвіЈКэөДКэЦөҪ«________ЈЁМоЎ°ФцҙуЎұЎўЎ°јхРЎЎұ»тЎ°І»ұдЎұЈ©ЎЈ
ўЫПВБРҙлК©ЦРДЬК№ЖҪәв»мәПОпЦРnЈЁCH3OHЈ©/nЈЁCO2Ј©ФцҙуөДКЗ________
AЈ®јУИлҙЯ»ҜјБ
BЈ®ідИлHeЈЁgЈ©Ј¬К№МеПөС№ЗҝФцҙу
CЈ®Ҫ«H2OЈЁgЈ©ҙУМеПөЦР·ЦАл
DЈ®ФЩідИл3molH2
ЈЁ2Ј©әПіЙ°ұөДИИ»ҜС§·ҪіМКҪОӘЈәN2(g)+3H2(g) 2NH3(g) ЎчH=-92 kJЎӨmol-1ЎЈ
2NH3(g) ЎчH=-92 kJЎӨmol-1ЎЈ
ўЩДіОВ¶ИПВЈ¬Иф°С10mol N2Ул30mol H2ЦГУЪМе»эОӘ10LөДГЬұХәПіЙЛюДЪЈ¬·ҙУҰҙпөҪЖҪәвЧҙМ¬КұЈ¬ІвөГЖҪәв»мәПЖшМеЦР°ұөДМе»э·ЦКэОӘ1/5Ј¬ФтёГОВ¶ИПВ·ҙУҰөДK=___________ЈЁҝЙУГ·ЦКэұнКҫЈ©ЎЈ
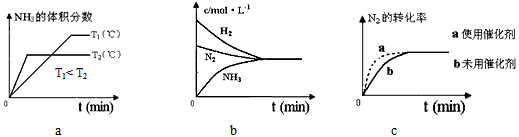
ўЪ¶ФУЪәПіЙ°ұ·ҙУҰ¶шСФЈ¬ПВБРУР№ШНјПуТ»¶ЁХэИ·өДКЗЈЁМоРтәЕЈ©_______________
ІОҝјҙр°ёЈәЈЁ1Ј©ўЩ0.225Ј»ўЪјхРЎЈ»ўЫCD
ЈЁ2Ј©ўЩ1/12 L2ЎӨmol-2ЈЁ»т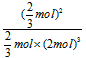 Ј©Ј»ўЪac
Ј©Ј»ўЪac
ұҫМвҪвОцЈә
ұҫМвДС¶ИЈәТ»°г
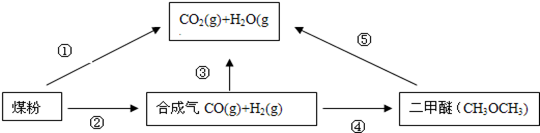
3ЎўМоҝХМв ЈЁ14·ЦЈ©ОӘБЛјхЙЩГәИјЙХ¶ФҙуЖшФміЙөДОЫИҫЈ¬ГәөДЖш»ҜәНТә»ҜКЗёЯР§ЎўЗеҪаАыУГГәМҝөДЦШТӘНҫҫ¶Ј¬¶шјхЙЩCO2ЖшМеөДЕЕ·ЕТІКЗИЛАаГжБЩөДЦШҙуҝОМвЈ®ГәЧЫәПАыУГөДТ»ЦЦНҫҫ¶ИзПВЛщКҫЈә
ЈЁ1Ј©ТСЦӘЈәC(s)+H2O(g)====CO(g)+H2(g) ЎчH1=+131.3kJ?mol-1
C(s)+2H2O(g)====CO2(g)+2H2(g) ЎчH2=+90kJ?mol-1
ФтТ»Сх»ҜМјУлЛ®ХфЖш·ҙУҰЙъіЙ¶юСх»ҜМјәНЗвЖшөДИИ»ҜС§·ҪіМКҪКЗ ЎЈ
ЈЁ2Ј©Ҫ«ИјГә·ПЖшЦРөДCO2ЧӘ»ҜОӘ¶юјЧГСөД·ҙУҰФӯАнОӘЈә2CO2(g)+6H2(g)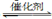 CH3OCH3(g)+3H2O(g)Ј»ҰӨH
CH3OCH3(g)+3H2O(g)Ј»ҰӨH
ўЩёГ·ҙУҰЖҪәвіЈКэұнҙпКҪОӘKЈҪ ЎЈ
ўЪТСЦӘФЪДіС№ЗҝПВЈ¬ёГ·ҙУҰФЪІ»Н¬ОВ¶ИЎўІ»Н¬Н¶БПұИКұЈ¬CO2өДЧӘ»ҜВКИзНјЛщКҫЎЈ
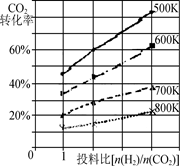
ёГ·ҙУҰөДҰӨH________(МоЎ°>ЎұЎўЎ°<Ўұ»тЎ°ЈҪЎұ)0ЎЈИфОВ¶ИІ»ұдЈ¬јхРЎ·ҙУҰН¶БПұИ[n(H2) /n(CO2)]Ј¬ФтKҪ«________(МоЎ°ФцҙуЎұЎўЎ°јхРЎЎұ»тЎ°І»ұдЎұ)ЎЈ
ЈЁ3Ј©Т»ЦЦРВРНЗвСхИјБПөзіШ№ӨЧчФӯАнИзПВНјЛщКҫЎЈ
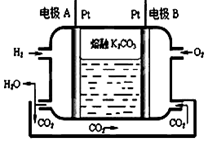
ўЩРҙіцөзј«AөДөзј«·ҙУҰКҪ ·Еөз№эіМЦРЈ¬ИЬТәЦРөДCO32-Ҫ«ТЖПтөзј« ЈЁМоA»тBЈ©
ўЪТФЙПКцөзіШөзҪвұҘәНКіСОЛ®Ј¬ИфЙъіЙ0.2mol Cl2Ј¬ФтЦБЙЩРиНЁИлO2өДМе»эОӘ LЈЁұкЧјЧҙҝцЈ©
ІОҝјҙр°ёЈәЈЁГҝҝХ2·ЦЈ¬№І14·ЦЈ©
ЈЁ1Ј©CO(g)+H2O(g)====CO2(g)+H2(g) ЎчH=-41.3kJ?mol-1Ј»
ЈЁ2Ј©ўЩ c(CH3OCH3)ЎБc3(H2O)]/[c2(CO2)ЎБc6(H2) ўЪ < І»ұд
ЈЁ3Ј©ўЩH2-2e-+CO32-= CO2+ H2OЈ»A
ўЪ2.24
ұҫМвҪвОцЈәЈЁ1Ј©ёщҫЭёЗЛ№¶ЁВЙөГЈ¬Т»Сх»ҜМјУлЛ®ХфЖш·ҙУҰЙъіЙ¶юСх»ҜМјәНЗвЖшөДИИ»ҜС§·ҪіМКҪОӘCO(g)+H2O(g)====CO2(g)+H2(g) ЎчH=ЎчH2-ЎчH1=+90kJ?mol-1-131.3kJ?mol-1=-41.3kJ?mol-1Ј»
ЈЁ2Ј©ўЩёщҫЭЖҪәвіЈКэөД¶ЁТеЈ¬ёГ·ҙУҰөДЖҪәвіЈКэK= c(CH3OCH3)ЎБc3(H2O)]/[c2(CO2)ЎБc6(H2)Ј»
ўЪёщҫЭНјПсҝЙЦӘЈ¬ЛжОВ¶ИЙэёЯЈ¬¶юСх»ҜМјөДЧӘ»ҜВКҪөөНЈ¬ЛөГчЙэёЯОВ¶ИЈ¬ЖҪәвДжПтТЖ¶ҜЈ¬ЛщТФХэ·ҙУҰКЗ·ЕИИ·ҙУҰЈ¬ҰӨH<0Ј»ЖҪәвіЈКэЦ»УлОВ¶ИУР№ШЈ¬ИфОВ¶ИІ»ұдЈ¬ јхРЎ·ҙУҰН¶БПұИ[n(H2) /n(CO2)]Ј¬ФтKҪ«І»ұдЈ»
ЈЁ3Ј©ўЩөзј«AНЁИлЗвЖшЈ¬·ўЙъСх»Ҝ·ҙУҰЈ¬ЛщТФAКЗёәј«Ј¬ЗвЖшК§ИҘөзЧУЈ¬УлМјЛбёщАлЧУҪбәПОӘЛ®әН¶юСх»ҜМјЖшМеЈ¬өзј«·ҙУҰКҪОӘЈәH2-2e-+CO32-= CO2+ H2OЈ»ФӯөзіШЦРЈ¬ТхАлЧУПтёәј«ТЖ¶ҜЈ¬ФтМјЛбёщАлЧУПтAј«ТЖ¶ҜЈ»
ўЪЙъіЙ0.2mol Cl2Ј¬ФтЧӘТЖ0.4molөзЧУЈ¬ёщҫЭO2+4e-+2CO2=2CO32-Ј¬ФтРиТӘСхЖшөДОпЦКөДБҝКЗ0.1molЈ¬ұкЧјЧҙҝцПВөДМе»эКЗ0.1molЎБ22.4L/mol=2.24LЎЈ
ҝјөгЈәҝјІйёЗЛ№¶ЁВЙөДУҰУГЈ¬ЖҪәвіЈКэөДұнКҫј°ЕР¶ПЈ¬ФӯөзіШ·ҙУҰФӯАнөДУҰУГ
ұҫМвДС¶ИЈәА§ДС
4ЎўСЎФсМв COCl2(g)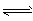 CO(g)+Cl2(g);ЎчH>0Бҝөұ·ҙУҰҙпөҪЖҪәвКұЈ¬ПВБРҙлК©ДЬМбёЯCOCl2ЧӘ»ҜВКөДКЗ
CO(g)+Cl2(g);ЎчH>0Бҝөұ·ҙУҰҙпөҪЖҪәвКұЈ¬ПВБРҙлК©ДЬМбёЯCOCl2ЧӘ»ҜВКөДКЗ
[? ]
ўЩЙэОВ ўЪәгИЭНЁИл¶иРФЖшМе ўЫФцјУCOөДЕЁ¶И ўЬјхС№ ўЭјУҙЯ»ҜјБ ўЮәгС№НЁИл¶иРФЖшМеЈ¬
AЈ®ўЩўЪўЬ
BЈ®ўЩўЬўЮ
CЈ®ўЪўЫўЮ
DЈ®ўЫўЭўЮ
ІОҝјҙр°ёЈәB
ұҫМвҪвОцЈә
ұҫМвДС¶ИЈәТ»°г
5ЎўМоҝХМв ЈЁұҫРЎМвВъ·Ц9·ЦЈ©
ЈЁ1Ј©°С6 mol AЖшМеәН5 mol BЖшМе»мәП·ЕИл4 LГЬұХИЭЖчЦРЈ¬ФЪТ»¶ЁМхјюПВ·ўЙъ·ҙУҰЈә3A(g)+B(g) 2C(g)+xD(g)Ј¬ҫӯ5minҙпөҪЖҪәвЈ¬ҙЛКұЙъіЙ2 mol CЈ¬ІвөГDөДЖҪҫщ·ҙУҰЛЩВКОӘ0.15 mol/(LЎӨmin)Ј¬ФтЖҪәвКұAөДОпЦКөДБҝЕЁ¶ИКЗ____________Ј»BөДЧӘ»ҜВККЗ__________Ј»xөДЦөКЗ___________ЎЈ
2C(g)+xD(g)Ј¬ҫӯ5minҙпөҪЖҪәвЈ¬ҙЛКұЙъіЙ2 mol CЈ¬ІвөГDөДЖҪҫщ·ҙУҰЛЩВКОӘ0.15 mol/(LЎӨmin)Ј¬ФтЖҪәвКұAөДОпЦКөДБҝЕЁ¶ИКЗ____________Ј»BөДЧӘ»ҜВККЗ__________Ј»xөДЦөКЗ___________ЎЈ
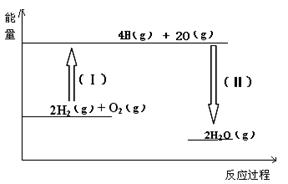
ЈЁ2Ј©·ҙУҰ2H2ЈЁgЈ© + O2ЈЁgЈ©ЈҪ 2H2OЈЁgЈ©өДДЬБҝұд»ҜИзНјЛщКҫЎЈТСЦӘІрҝӘ1molH2Ўў1molO2әН1molH-OЦРөД»ҜС§јь·ЦұрРиТӘПыәД436KJЎў496KJәН463KJДЬБҝЈ¬ФтёГ·ҙУҰ??ЈЁМоЎ°ОьКХЎұ »тЎ°·ЕіцЎұЈ©??KJИИБҝЎЈ
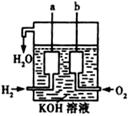
ЈЁ3Ј©ГА№ъ°ўІЁВЮУоЦж·Йҙ¬ЙПК№УГБЛТ»ЦЦРВРНЧ°ЦГЈ¬Жд№№ФмИзУТНјЛщКҫЈә
aЎўbБҪёцөзј«ҫщУЙ¶аҝЧөДМјҝйЧйіЙЎЈРҙіцaј«өДөзј«·ҙУҰКҪЈә?ЎЈ
ЈЁ4Ј©№ӨТөЙПУГөзҪвұҘәНКіСОЛ®өД·Ҫ·ЁЦЖИЎҪрКфВИЖшЈ¬·ҙУҰЦРДЬБҝөДЧӘ»ҜРОКҪКЗ?Ј»ВИЖшФЪ?ј«ЙПІъЙъЈ¬·ҙУҰәуИЬТәөДpH?ЎЈЈЁМоЎ°ФцҙуЎұ»тЎ°јхРЎЎұЈ©ЎЈ
ІОҝјҙр°ёЈәЈЁ9·ЦЈ¬ГҝҝХёч1·ЦЈ©ЈЁ1Ј©0.75mol/L? 20%? 3?ЈЁ2Ј©·Еіц? 484
ЈЁ3Ј©H2 +2OHЈӯЈӯ2eЈӯЈҪ2H2O?ЈЁ4Ј©өзДЬЧӘ»ҜОӘ»ҜС§ДЬ?Сф?Фцҙу
ұҫМвҪвОцЈәЈЁ1Ј©DөДЖҪҫщ·ҙУҰЛЩВКОӘ0.15 mol/(LЎӨmin)Ј¬ЛщТФЙъіЙОпBАҙФҙ:91 ҝјКФНшЖҪәвКұОпЦКөДБҝКЗ0.15 mol/(LЎӨmin)ЎБ5minЎБ4LЈҪ3molЈ¬ТтОӘОпЦКөДБҝөДұд»ҜБҝҫНКЗПаУҰөД»ҜС§јЖБҝКэЦ®ұИЈ¬ЛщТФxЈҪ3.ПыәДABөДОпЦКөДБҝ·ЦұрКЗ3molәН1molЈ¬ТтҙЛЖҪәвКұAөДЕЁ¶ИКЗЈЁ6molЈӯ3molЈ©ЎВ4LЈҪ0.75mol/LЈ¬BөДЧӘ»ҜВККЗ1ЎВ5ЎБ100ЈҘЈҪ20ЈҘЎЈ
ЈЁ2Ј©·ҙУҰИИҫНКЗ¶ПјьОьКХөДДЬБҝәНРОіЙ»ҜС§јьЛщ·ЕіцөДДЬБҝөДІоЦөЈ¬ЛщТФёГ·ҙУҰ·ЕіцөДДЬБҝКЗ2ЎБ2ЎБ463KJЈӯ2ЎБ436KJЈӯ496KJЈҪ484KJЎЈ
ЈЁ3Ј©aј«НЁИлөДКЗҝХЖшЈ¬ЛщТФКЗёәј«Ј¬УЦТтОӘөзҪвЦКИЬТәКЗЗвСх»ҜјШЈ¬ЛщТФёәј«·ҙУҰКҪОӘH2 +2OHЈӯЈӯ2eЈӯЈҪ2H2O ЎЈ
ЈЁ4Ј©өзҪвКЗ°СөзДЬЧӘ»ҜОӘ»ҜС§ДЬөДЧ°ЦГЎЈөзҪвіШЦРТхАлЧУФЪСфј«·ЕөзЈ¬ЛщТФСфј«ІъЙъВИЖшЎЈТхј«КЗЗвАлЧУ·ЕөзЈ¬ІъЙъЗвЖшЎЈЛщТФИЬТәЦРІъЙъЗвСх»ҜДЖЈ¬ПФјоРФЈ¬pHФцҙуЎЈ
ұҫМвДС¶ИЈәТ»°г