1、填空题 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g) 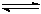 ?Si3N4(s)? + 6CO(g)
?Si3N4(s)? + 6CO(g)
(1)该反应的氧化剂是?,2molN2参加反应转移电子数为?;
(2)该反应的平衡常数表达式为K= ? ;
(3)若CO的生成速率为v(CO)=18mol·L-1·min-1,则N2的消耗速率为v(N2)=?
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。图中t4时引起平衡移动的条件可能是?;图中表示平衡混合物中CO的含量最高的一段时间是?。

(5)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是?(提示:272 = 729)
参考答案:(1)氮气 (1分) ?12NA? (1分)(2)K=[c(CO)]6/[c(N2)]2? (2分)(3)6 mol?L-1?min-1 (1分) ?(4)升高温度或增大压强(2分) ?t3~t4(2分) ?(5)50%(2分)
本题解析:(1)反应中N元素的化合价降低,有0价降为-3价,则氧化剂为氮气,氧化剂对应的生成物为还原产物,应为氮化硅,故答案为:氮气;氮化硅;(2)平衡常数等于气体生成物的浓度幂之积除以气体反应物的浓度幂之积,则K=[c(CO)]6/[c(N2)]2(3)反应放热,△H<0,升高温度平衡移动逆反应方向移动,平衡常数减小,速率之比等于化学计量数之比,则v(N2)=1/3×v(CO)=1/3×18mol?L-1?min?1="6" mol?L-1?min?1(4) t4时正逆反应速率都较原平衡时的速率大,可升高温度或增大压强,在t4时反应向逆反应方向移动,则t3~t4时平衡混合物中CO的含量最高,故答案为:升高温度或增大压强,t3~t4;
(5)设反应的N2的物质的量为x,
3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
起始:? 2mol?0
转化:? x?3x
平衡:? 2-x?3x
则平衡时N2的浓度为(2-x)mol/L,CO的浓度为3x mol/L,则有:(3x)6/(2-x)2=729,解之得x=1,则N2的转化率是50%。
本题难度:困难
2、选择题 一定温度下,恒容密闭容器中进行的反应:A(s)+3B(g)═2C(g)+D(g),当下列物理量不再发生变化时就可确定达到平衡状态的是( )
A.各物质的浓度不随时间变化
B.容器的压强不再变化
C.B的生成速率和D的生成速率为3:1
D.B、C、D的分子数之比为3:2:1
参考答案:A.当化学反应达到平衡状态时,各物质的浓度不变,故A正确;
B.A为固体,反应前后气体的化学计量数之和相等,无论是否达到平衡状态,压强不变,不能从压强的角度判断化学反应是否达到平衡状态,故B错误;
C.B的生成速率和D的生成速率为3:1,说明正逆反应速率相等,反应达到平衡状态,故C正确;
D.平衡时的浓度取决于起始物质的配料比以及转化的程度,不能用以判断是否达到平衡状态,故D错误.
故选AC.
本题解析:
本题难度:一般
3、选择题
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)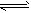 Z(g)+W(s)ΔH>0下列叙述正确的是
Z(g)+W(s)ΔH>0下列叙述正确的是
[? ]
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.平衡后加入X,上述反应的ΔH增大
参考答案:B
本题解析:
本题难度:一般
4、简答题 在容积为2L的密闭容器中,进行反应:A(g)+2B(g)C(g)+D(g)
在不同温度下,D的物质的量n(D)和时间t的关系如图所示.试回答下列问题:
(1)800℃时,0-5min内,以B的浓度变化表示的平均反应速率为______.
(2)能判断该反应达到化学平衡状态的依据是______.
a.容器中压强不变
b.混合气体中c(A)不变
c.2v正(B)=v逆(D)
d.A、B、C、D四者共存
(3)该反应的正反应为______反应(填吸热或放热);判断的理由是______.
(4)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K(要求有计算过程).
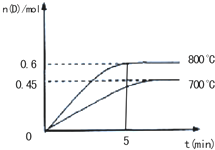
参考答案:(1)由图象可知,800℃时,0-5min内D的物质的量的变化为0.6mol,则参加反应的B的物质的量为1.2mol,则v(B)=nVt=1.2mol2L5min=0.12mol?L-1?min-1,
故答案为:0.12mol?L-1?min-1;
(2)a.根据方程式可知,反应后气体的物质的量减小,压强减小,当容器中压强不变时,即是平衡状态,故a正确;
b.混合气体中c(A)不变时,则A的正逆反应速率相等,是平衡状态,故b正确;
c.不同物质表示反应速率时,正逆反应速率之比等于化学计量数之比是平衡状态,则v正(B)=2v逆(D)是平衡状态,故c错误;
d.当反应开始后,A、B、C、D四者共存,但平衡不一定达到平衡状态,故d错误;
故答案为:ab;
(3)由图象可知,800℃时D的物质的量大于700℃时D的物质的量,说明温度越高,D的物质的量越大,则升高温度平衡正移,所以正方向为吸热方向,
故答案为:吸热;温度高,D的含量大,依据勒夏特列原理,升温有利于吸热反应;
(4)若最初加入1.0molA和2.2molB,设参加反应的A为nmol,
A(g)+2B(g)?C(g)+D(g)
初始的量:(mol) 1.0 2.2 0 0
反应的量:(mol) n 2n n n
平衡的量:(mol)1-n 2.2-2n nn
由图象可知平衡时D的物质的量为0.6mol,即n=0.6mol,则平衡时c(A)=1-nV=0.2mol/L,c(B)=2.2-2nV=0.5mol/L,
c(C)=c(D)=0.6mol2L=0.3mol/L,则K=0.3×0.30.2×0.52=1.8,
答:800℃时的平衡常数K为1.8.
本题解析:
本题难度:一般
5、选择题 下列关于化学反应限度的说法正确的是?
[? ]
A.当一个可逆反应达到平衡状态时,就是这个反应所能达到的限度
B.当一个可逆反应进行到平衡状态时,这个反应的正向反应速率和逆向反应速率相等
C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已不再改变
D.化学反应的限度不可以通过改变条件而改变
参考答案:B
本题解析:
本题难度:简单