1、选择题 下列有关实验的叙述正确的是( )
A.容量瓶不能用作长期存放试剂的容器,但是当溶液配制完后,可以用来存放配制的试剂
B.用500mL的容量瓶可以直接配制480mL溶液
C.容量瓶不可以用来溶解固体,但是可以用来稀释浓的溶液
D.容量瓶不可以用来加热,但是锥形瓶可以用来加热
参考答案:D
本题解析:
本题难度:简单
2、计算题 (6分)用31.6g KMnO4氧化密度为1.19g/cm3,溶质质量分数为36.5%的盐酸,反应方程式如下:2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑?+ 8H2O
⑴该盐酸的物质的量浓度为??
⑵有?mol HCl被氧化?
⑶产生的Cl 2在标准状况下的体积为??
参考答案:(1)11.9mol/L?(2)1mol?(3)11.2L
本题解析:考查物质的量的有关计算。
(1)根据 可知,盐酸的浓度是
可知,盐酸的浓度是 。
。
(2)31.6g KMnO4的物质的量是31.6g÷158g/mol=0.2mol,得到0.2mol×5=1.0mol电子。氯元素的化合价从-1价升高到0价,所以被氧化的盐酸的物质的量是1mol。
(3)根据方程式可知生成氯气的物质的量是0.5mol,所以在标准状况下的体积是0.5mol×22.4L/mol=11.2L。
本题难度:一般
3、选择题 在100 mL某浓度的NaOH溶液中通入一定量的CO2气体,得到溶液X,再向溶液X中逐滴加入0.1mol/L的盐酸,产生的气体体积与加入盐酸的体积关系如下图所示,有关说法错误的是(? )
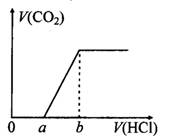
A.若a:b<1:2,则0~a段发生的离子反应为:CO32-+H+= HCO3-
B.若a:b>l:2,且b="20" mL,则原NaOH溶液的浓度为0.02 mol/L
C.若a:b=1:2,则溶液X中离子浓度满足:c(H+)+c(HCO3-)=c(OH-)-c(H2CO3)
D.a:b为任意值时,溶液X中离子浓度均满足:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
参考答案:C
本题解析:A、若a:b<1:2,则溶液X的溶质为Na2CO3和NaHCO3,刚开始滴加盐酸时反应为Na2CO3+HCl=NaHCO3+NaCl,正确;B、b点溶液的溶质为NaCl,由Na元素、Cl元素守恒可知:n(NaOH)="n(NaCl)=n(HCl)=0.002" mol,故原溶液中NaOH浓度为0.02 mol/L,正确;C、若a:b=l:2,则溶液X的溶质为Na2CO3,质子守恒式有:c(H+)+c(HCO3-)=c(OH-)一2c(H2CO3),错误;D、a:b为任意值时溶液X均满足电荷守恒,即c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),正确;
本题难度:一般
4、选择题 已知标准状况下:①6.72L CH4?②3.01×1023HCl?③23.1g CCl4?④2.3g Na,下列对四种物质的
关系由小到大表示正确的是
A.体积④<①<②<③
B.密度①<④<③<②
C.原子数④<③<②<①
D.质量④<①<③<②
参考答案:C
本题解析:①V(CH4)=6.72L,n(CH4)= 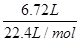 =0.3mol,m(CH4)=0.3mol×16g/mol=4.8g,ρ=
=0.3mol,m(CH4)=0.3mol×16g/mol=4.8g,ρ=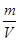 =
=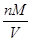 =0.714×10-3kg/L,N(原子数)=5×n(CH4)×NA/mol=1.5NA;②n(HCl)=
=0.714×10-3kg/L,N(原子数)=5×n(CH4)×NA/mol=1.5NA;②n(HCl)=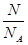 =
=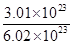 =0.5mol,V(HCl)= n(HCl)×22.4L/mol=11.2L,m(HCl)=0.5mol×36.5g/mol=18.25g,ρ=
=0.5mol,V(HCl)= n(HCl)×22.4L/mol=11.2L,m(HCl)=0.5mol×36.5g/mol=18.25g,ρ=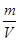 =1.62×10-3kg/L, N(原子数)=2×n(HCl)×NA/mol=0.6NA;③m(CCl4)=23.1g,n(CCl4)=
=1.62×10-3kg/L, N(原子数)=2×n(HCl)×NA/mol=0.6NA;③m(CCl4)=23.1g,n(CCl4)= 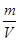 =0.15mol,N(原子数)=5×n(CCl4 )×NA/mol=0.6NA ,CCl4 标准状况下为液体,故其密度体积无法比较;④m(Na)=2.3g,n(Na)=0.1mol,N(原子数)=1×n(Na)×NA/mol="0.1" NA,因为Na为金属,故其密度体积无法比较。故C正确。
=0.15mol,N(原子数)=5×n(CCl4 )×NA/mol=0.6NA ,CCl4 标准状况下为液体,故其密度体积无法比较;④m(Na)=2.3g,n(Na)=0.1mol,N(原子数)=1×n(Na)×NA/mol="0.1" NA,因为Na为金属,故其密度体积无法比较。故C正确。
本题难度:一般
5、选择题 设NA为阿伏加德罗常数的值。下列叙述正确的是
A.1.7 g羟基所含电子的数目为NA
B.0.1 mol丙烯醛中含有双键的数目为0.1NA。
C.室温时,pH=13的1.0L Ba(OH)2溶液中含有OH-的数目为0.2NA
D.标准状况下,7.8 g苯中含氢原子的数目为0.6NA