1、实验题 仔细阅读给CuSO4·5H2O晶体加热过程中依次发生的如下反应:
CuSO4·5H2O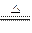 CuSO4+5H2O,CuSO4
CuSO4+5H2O,CuSO4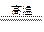 CuO+SO3
CuO+SO3
4CuO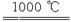 2Cu2O+O2,2SO3
2Cu2O+O2,2SO3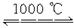 2SO2+O2
2SO2+O2
今取25.0 g CuSO4·5H2O晶体加热,使之均匀、缓慢升温至1000 ℃,并恒温1 h。请完成下列问题:
(1)最终所得固体的颜色为____________,质量为____________ g。
(2)不考虑实验带来的误差,在反应条件下,反应后的除去水后的气态产物的物质的量可能为____________(填写下列选项)。
A.0? B.0.1 mol? C.大于0.1 mol
(3)(2)问中除上述三个选项外,你认为更准确的范围应该是什么?并予以说明。
(4)如果某同学做此实验时,最后固体质量为7.6 g,试通过计算判断该固体物质的组成,其物质的量各是多少?
参考答案:(1)红(或砖红)色? 7.2? (2)C
(3)CuO分解生成0.025 mol O2,SO3分解是可逆反应,故SO3分解反应混合物大于0.1 mol,小于0.15 mol,所以气体的总物质的量大于0.125 mol,小于0.175 mol
(4)剩余固体7.6 g,介于7.2—8.0 g之间,故为CuO和Cu2O混合物。
n(Cu)=n(CuSO4·5H2O)="0.1" mol
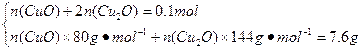
n(CuO)="0.05" mol
n(Cu2O)="0.025" mol
本题解析:由题给信息知,反应最终固体产物是红色的Cu2O,并由Cu元素守恒得m(Cu2O)= 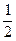 n(CuSO4·5H2O)×M(Cu2O)=
n(CuSO4·5H2O)×M(Cu2O)=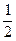 ×0.1 mol×144 g·mol-1="7.2" g。若不考虑误差,0.1 mol CuSO4分解产生SO3和CuO各0.1 mol,CuO又分解生成0.025 mol O2,由于SO3分解是可逆反应,反应混合物大于0.1 mol,小于0.15 mol,所以气体的总物质的量大于0.125 mol,小于0.175 mol。由于0.1 mol CuSO4·5H2O高温分解可得0.1 mol CuO,即质量为8.0 g,CuO继续分解最终可得7.2 g Cu2O。如果最后固体质量为7.6 g,介于7.2 g—8.0 g之间,说明是CuO和Cu2O的混合物,可依据Cu元素守恒列方程组求解其物质的量。
×0.1 mol×144 g·mol-1="7.2" g。若不考虑误差,0.1 mol CuSO4分解产生SO3和CuO各0.1 mol,CuO又分解生成0.025 mol O2,由于SO3分解是可逆反应,反应混合物大于0.1 mol,小于0.15 mol,所以气体的总物质的量大于0.125 mol,小于0.175 mol。由于0.1 mol CuSO4·5H2O高温分解可得0.1 mol CuO,即质量为8.0 g,CuO继续分解最终可得7.2 g Cu2O。如果最后固体质量为7.6 g,介于7.2 g—8.0 g之间,说明是CuO和Cu2O的混合物,可依据Cu元素守恒列方程组求解其物质的量。
本题难度:简单
2、简答题 实验室需要480mL0.2mol?L-1的氢氧化钠.配制方法如下:
(1)配制该溶液应选用______ml的容量瓶.
(2)用托盘天平准确称量______g固体NaOH.
(3)将称量好的NaOH固体放在500ml大烧杯中,倒入约300ml蒸馏水,用玻璃棒搅拌,使固体全部溶解,待______后,将烧杯中的溶液注入容量瓶中.
(4)用少量的蒸馏水洗涤烧杯和玻璃棒______次,洗涤后的溶液______,轻轻振荡容量瓶,使溶液混合均匀.
(5)向容量瓶中加入蒸馏水,至距刻度线______处,改用______滴加蒸馏水至液面与刻度线相切.
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是
______,偏低的是______,对实验结果没有影响的是______.(填各选项的序号)
A、所用的NaOH中混有少量NaCl?B、定容时俯视液面与刻度线相切
C、转移溶液后,未洗涤烧杯和玻璃棒就进行定容?D、溶解后未冷却就转移定容
E、容量瓶使用前未干燥.
参考答案:(1)没有480mL的容量瓶,选择大于且相近规格的容量瓶,以免浪费药品,故应选择500mL容量瓶,故答案为:500;
(2)配制500mL0.2mol?L-1的氢氧化钠溶液,需要氢氧化钠的质量为0.5L×0.2mol?L-1×40g/mol=4.0g,故答案为:4.0;
(3)氢氧化钠溶解放出大量的热,会影响溶液的体积,应冷却后再转移到容量瓶中,故答案为:冷却;
(4)玻璃棒、烧杯壁上都沾有少量氢氧化钠,故应用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液移入容量瓶中,
故答案为:2~3;移入容量瓶中;
(5)向容量瓶中加入蒸馏水,至距刻度线1cm~2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切,
故答案为:1cm~2cm;胶头滴管;
(6)A、所用的NaOH中混有少量NaCl,实际称量的氢氧化钠的质量偏小,所配溶液浓度偏低;
B、定容时俯视液面与刻度线相切,导致溶液液面在刻度线以下,溶液的体积偏小,所配溶液浓度偏高;
C、转移溶液后,未洗涤烧杯和玻璃棒就进行定容,玻璃棒、烧杯壁上都沾有少量氢氧化钠,移入容量瓶内氢氧化钠的物质的量偏小,所配溶液浓度偏低;
D、溶解后未冷却就转移定容,溶液冷却后溶液的体积偏小,所配溶液浓度偏高;
E、配制需加水定容,容量瓶使用前未干燥,对所配溶液浓度无影响;
故答案为:BD;AC;E.
本题解析:
本题难度:一般
3、选择题 1L稀硝酸和稀硫酸的混合溶液,其溶质的物质的量浓度分别为0.1mol/L 和0.2mol/L。若向该混合溶液中加入足量的铜粉。则最多能溶解铜粉的质量为
A.2.4 g
B.3.2 g
C.6.4 g
D.9.6 g
参考答案:D
本题解析:发生3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,n(H+)=0.5mol,n(NO3-)=0.1mol,氢离子过量,故能溶解0.15mol铜,质量为9.6g。
本题难度:一般
4、选择题 物质的量浓度相同的NaCl、MgCl2、AlCl3 3种溶液,当它们的体积比为3:2:1时,3种溶液中Cl
参考答案:
本题解析:
本题难度:一般
5、选择题 设NA为阿伏伽德罗常数的值。下列说法正确的是(?)
A.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B.1 mol Na2O2固体中含离子总数为4NA
C.标准状况下,11.2L苯中含有分子的数目为0.5NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
参考答案:A
本题解析:A.1.6g由氧气和臭氧组成的混合物中O原子的物质的量是0.1mol,所以含有氧原子的数目为0.1NA,正确;B.一个Na2O2固体含有3个离子,所以1 mol Na2O2固体中含离子总数为3NA,错误;C.标准状况下,苯是液体,所以不能使用气体摩尔体积,错误;D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.2 NA,错误。
本题难度:一般