1、填空题 下表是元素周期表的一部分,请用元素符号或化学式回答有关问题:
主族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
2
①
②
③
3
④
⑤
⑥
⑦
⑧
⑨
|
(1)表中化学性质最活泼的金属元素是______,最活泼的非金属元素是______.
(2)表中能形成两性氧化物的元素是______,写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式______.
(3)③⑦⑧三种元素原子半径由大到小的顺序是______.③⑤⑥三种元素离子半径由大到小的顺序是______.
(4)⑧元素的最高价氧化物的水化物是______.
(5)③⑦⑧三种元素形成的氢化物的稳定性大到小顺序为______.
参考答案:由元素在周期表中的位置可知,①为C,②为N,③为F,④为Na,⑤为Mg,⑥为Al,⑦为S,⑧为Cl,⑨为Ar,
(1)周期表中,从上到下金属性逐渐增强、非金属性减弱,从右到左金属性逐渐减弱、非金属性增强,故上述表中最活泼的金属元素为Na,最活泼的非金属元素为F,
故答案为:Na;F;
(2)Al的氧化物氧化铝属于两性氧化物,铝与氢氧化钠反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:Al;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径O>Cl>F,
电子层结构相同,核电荷数越大离子半径越小,故离子半径F->Mg2+>Al3+,
故答案为:O>Cl>F;F->Mg2+>Al3+;
(4)Cl元素的最高价氧化物的水化物为HClO4,
故答案为:HClO4;
(5)非金属性F>Cl>S,故氢化物稳定性HF>HCl>H2S,
故答案为:HF>HCl>H2S.
本题解析:
本题难度:一般
2、填空题 在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1mol XY2含有54 mol电子。
(1)该融雪剂的化学式是_______________;X与氢元素形成的化合物的电子式是______________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是
_______________;D与E能形成一种非极性分子,该分子的结构式为_______________;D所在族元素的氢化物中,沸点最低的是_______________。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是_______________。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与水反应的化学方程式为___________________。
参考答案:(1)CaCl2;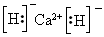
(2) ;S=C=S;H2S
;S=C=S;H2S
(3)Si3N4
(4)2F2+2H2O==4HF+O2
本题解析:
本题难度:一般
3、推断题 (12分)非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:

(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是________;
②在工业生产中B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别是:A________;C________.
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式___________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
参考答案:(每空2分,共12分)
(1)①H2SO4 ②酸雨
(2)①N2 NO2
②Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O?属于
本题解析:(1)B是能使品红溶液褪色的有刺激性气味的无色气体,可断定B为SO2,A为S,C为SO3,D为H2SO4,且会形成酸雨。(2)C是红棕色的气体,可断定C为NO2,B为NO,A为N2,D为HNO3。Cu与HNO3(浓)反应生成NO2气体,其反应方程式为:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,分析反应中元素的化合价发生了变化,故次化学反应属于氧化还原反应。
点评:本题重点考查的是无机反应,涉及到S和N2的相关联的化学反应,且发生的化学反应都源自于教材,只有学生认真学习教材知识,问题就迎刃而解了。
本题难度:一般
4、选择题 关于卤素的下列叙述正确的是
[? ]
A.卤素只以化合态存在于自然界中
B.随着核电荷数的增加,卤素单质的熔、沸点升高
C.随着核电荷数的增加,单质的氧化性增强
D.单质与水反应,均可用通式X2+H2O=HX+HXO表示
参考答案:AB
本题解析:
本题难度:一般
5、简答题 下表是元素周期表的一部分,回答下列有关问题(用化学符号回答):
族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
2
①
②
③
3
④
⑤
⑥
⑦
⑧
⑨
4
⑩
|
(1)在①~⑩元素中,最活泼的金属元素是______,最活泼的非金属元素是______,最不活泼的元素是______.
(2)在①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是______,碱性最强的是______,呈两性的是______.写出在水溶液中三者之间相互反应的离子方程式:______,______,______.
参考答案:(1)根据元素周期表性质的递变规律,最活泼的金属应在第IA,最活泼的非金属应在第VIIA,惰性气体最不活泼,则在IA元素Na(④)和K(⑩)中K最活泼;在VIIA的元素Cl(⑧)和F(③)中,F最活泼;最不活泼的是⑨即Ar,故答案为:K;F;Ar;
(2)元素的最高价氧化物对应水化物中,酸性最强的必是非金属性增强的,根据同周期、同主族元素非金属性的递变规律可知,元素非金属性最强的是③即F,但F无最高正价,因为我们知道,HClO4已知的最高价含氧酸中酸性最强的,即酸性最强的是HClO4.元素的最高价氧化物对应水化物中,碱性最强的必是非金属性增强的,根据同周期、同主族元素金属性的递变规律可知,元素金属性最强的是⑩即K,则碱性最强的必是KOH,在表中所列元素的最高价氧化物对应水化物中,只有Al(OH)3具有两性,和强酸反应的实质是:3H++Al(OH)3=Al3++3H2O,和强碱之间的反应实质是:Al(OH)3+OH-=AlO2-+2H2O,强酸和强碱之间的反应实质是:H++OH-=H2O,故答案为:3H++Al(OH)3=Al3++3H2O;Al(OH)3+OH-=AlO2-+2H2O;H++OH-=H2O.
本题解析:
本题难度:一般