| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《弱电解质电离平衡》高频考点预测(2017年最新版)(四)
参考答案:C 本题解析:氨水是弱碱溶液,加水稀释,会促进一水合氨的电离,所以电离度增大;氢氧根离子物质的量增大,但溶液的体积增大的更多,所以最终氢氧根离子浓度减小,铵根离子浓度减小,氢离子浓度增大;因为温度不变,所以水的离子积常数不变;离子的浓度减小,所以导电性减弱;C(OH-)/C(NH3 ·H2O)=KW/c(NH4+),铵根离子浓度减小,所以C(OH-)/C(NH3 ·H2O)增大,则答案选C。 本题难度:一般 2、选择题 在醋酸溶液中存在电离平衡CH3COOH?CH3COO-+H+,要使电离平衡向右移动且c(H+)增大,可采取的措施是( ) 参考答案:A、加入氢氧化钠固体,氢氧化钠和氢离子反应生成水,能促进醋酸的电离,但氢离子浓度减小,故A错误; 本题解析: 本题难度:简单 3、选择题 在室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是 |
参考答案:C
本题解析:A.硝酸和氢氧化钡都是强电解质,pH=3的硝酸和pH=11的Ba(OH)2溶液中,硝酸中氢离子浓度等于氢氧化钡溶液中氢氧根离子浓度,二者等体积混合时恰好反应生成硝酸钡,溶液呈中性,故A错误;B.氯化氢是强电解质,一水合氨是弱电解质,所以pH=3的盐酸和pH=11的氨水,盐酸的浓度小于氨水浓度,二者等体积混合,氨水有剩余,一水合氨的电离程度大于铵根离子的水解程度,所以混合溶液呈碱性,故B错误;醋酸是弱电解质,氢氧化钾是强电解质,所以pH=3的醋酸和pH=11的KOH溶液,醋酸溶液浓度大于氢氧化钾溶液,二者等体积混合时,醋酸有属于,醋酸的电离程度大于醋酸根离子水解程度,所以混合溶液呈酸性,故C正确;硫酸和氢氧化钠都是强电解质,pH=3的硫酸中氢离子浓度为0.001mol/L,pH=11的KOH溶液中氢氧根离子浓度为0.001mol/L,等体积混合,二者恰好反应生成硫酸钾,混合溶液呈中性,故D错误;故选C。
考点:酸碱混合时pH的计算
本题难度:一般
4、选择题 下列说法正确的是
A.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
B.已知AgCl的Ksp=1.8×10-10、Ag2CrO4的Ksp=1.2×10-12,所以相同温度下AgCl的溶解度大于Ag2CrO4
C.常温下,将pH =8的醋酸钠溶液稀释,溶液中所有离子浓度都减小
D.反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0
参考答案:AD
本题解析:A、镀铜铁制品镀层受损后,形成铁铜原电池,铁作负极,腐蚀速率加快,正确;B、AgCl与Ag2CrO4的系数不同,不能直接根据Ksp的大小判断溶解度的大小,错误;C、将pH =8的醋酸钠溶液稀释,溶液中H+浓度增大,错误;D、反应自发进行,说明?H—T?S < 0,该反应气体减少,?S < 0,则△H<0,正确。sp的应用、离子浓度判断、自发反应的分析。
本题难度:一般
5、选择题 分别在等体积等pH或等物质的量浓度的盐酸和醋酸溶液中,加入足量锌粉,氢离子浓度c(H+)及氢气的体积V(H2)(同温同压下测定)的变化图示如下,其中正确的是? (? )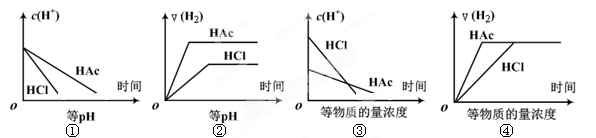
A.①②③
B.②④
C. ①③
D.①②③④
参考答案:A
本题解析:①随着反应的进行,氢离子浓度逐渐减小但是醋酸会逐渐电离出氢离子,所以醋酸中氢离子消耗的速率慢,正确;②等pH时,醋酸浓度较大,加入足量锌,不仅产生的氢气的体积更大,而且反应更快,正确;③等浓度的盐酸和醋酸,盐酸的pH小,和金属锌反应的速率比醋酸的快正确;④等浓度的盐酸和醋酸,因为盐酸是强酸,醋酸是弱酸,盐酸中H+浓度大,和金属锌反应的速率是盐酸比醋酸的快,错误,故A项正确。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《离子共存》.. | |