1、计算题 (7分)合成氨工厂通常测定反应前后混合气体的密度来确定氮气的转化率。某工厂测得进入合成塔的N2和H2混合气体的密度为0.553 6 g·L-1(标准状况),从合成塔出来的混合气体在相同条件下的密度为0.693 g·L-1。求该合成氨厂N2的转化率。
2、计算题 CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)? ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g)? ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
实验编号
| 温度
| ?
时间
| 0
| 10
| 20
| 40
| 50
|
1
| 130℃
| n(CH4)/mol
| 0.50
| 0.35
| 0.25
| 0.10
| 0.10
|
2
| 180℃
| n(CH4)/mol
| 0.50
| 0.30
| 0.18
| ?
| 0.15
|
?
(1)开展实验1和实验2的目的是?。
(2)180℃时,反应到40min,体系?(填“是”或“否”)达到平衡状态,理由是?;CH4的平衡转化率为?。
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值。(写出计算过程)
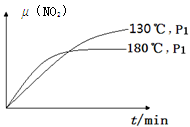
(4)一定条件下,反应时间t与转化率μ(NO2)的关系如图所示,请在图像中画出180℃时,压强为P2(设压强P2>P1)的变化曲线,并做必要的标注。
(5)根据已知求算:ΔH2=?。
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g)? ΔH1=?574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g)? ΔH1=?574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g)? ΔH2
2N2(g)+CO2(g)+2H2O(g)? ΔH2
3、填空题 (10分)常温下,将0.02molNaOH和0.1molNH4Cl溶于水配成1L溶液,
(1)(6分)该溶液中存在的三个平衡体系为_______?__ 、_?_、?_____? _? _? ___。
(2)(2分)溶液中共有?种不同的粒子。
(3)(2分)物质的量之和为0.1mol的两种粒子是___? __、?。
4、选择题 对于反应A2(g) + 2B2(g) 2AB2(g)(正反应为放热反应),下列各图所表示的变化符合勒夏特列原理的是
2AB2(g)(正反应为放热反应),下列各图所表示的变化符合勒夏特列原理的是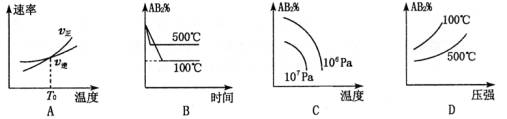
5、填空题 某温度下,在一固定容积的容器中进行如下反应N2+3H2? ?2NH3,下列情况一定能说明反应已达到限度的是:?。(填序号)
?2NH3,下列情况一定能说明反应已达到限度的是:?。(填序号)
① 容器内气压不随时间变化? ② 1个N≡N键断裂的同时,有6个N—H键断裂
③?用N2、H2、NH3的物质的量浓度变化表示化学反应速率的比为1:3:2。
④ 容器内气体密度不再改变 ⑤ 混合气的平均相对分子质量不随时间变化