|
高中化学知识点总结《反应速率与平衡的有关计算》高频考点预测(2017年最新版)(八)
2017-11-05 22:13:47
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 一定温度下在容积恒定的密闭容器中,进行可逆反应: A(s)+2B(g) C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到该条件下的最大限度的是 C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到该条件下的最大限度的是
①容器内气体的压强?②混合气体的密度
③混合气体的平均相对分子质量?④B的物质的量
A.只有④
B.②③
C.②③④
D.①④
参考答案:C
本题解析:反应前后气体的体积不变,所以容器内气体的压强始终不变。密度是混合气的质量和容器容积的比值,容器体积不变,但气体的质量是变化的,所以②可以说明。混合气体的平均相对分子质量是混合气的质量和混合气的物质的量的比值,气体的物质的量不变,但质量变化,所以③可以说明。当气体的物质的量不再发生变化时,反应即达到平衡状态。所以答案选C。
本题难度:一般
2、选择题 合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g)?ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 2NH3(g)?ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
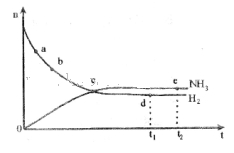
A.点a的正反应速率比点b的小
B.点c处反应达到平衡
C.点d(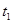 时刻)和点e( 时刻)和点e( 时刻)处n( 时刻)处n(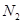 )不一样 )不一样
D.其他条件不变,773K下反应至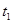 时刻,n(H2)比上图 时刻,n(H2)比上图
| 中d点的值大
参考答案:D
本题解析:A可能反应在c点之后才达到平衡。在平衡之前,正反应速率大于逆反应速率。错误。C c点时氨气与氢气的物质的量相等,但由于它们的浓度还发生变化,所以并未达到平衡。错误。C 在c点、d点由于外界条件没变,所以是同一条件下的平衡,氮气的物质的量相同。错误。D.题目给定温度是673K,若其他条件不变,773K下反应至t1时刻,温度升高,化学平衡向吸热方向移动即向逆反应方向移动。所以在平衡时氢气的含量要比673K高。正确。
本题难度:一般
3、选择题 设反应①Fe(s)+CO2(g)  FeO(s)+CO(g) ΔH=a kJ/mol,反应②Fe(s)+H2O(g) FeO(s)+CO(g) ΔH=a kJ/mol,反应②Fe(s)+H2O(g)  FeO(s)+H2(g) ΔH=b kJ/mol,以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下: FeO(s)+H2(g) ΔH=b kJ/mol,以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下:
T/K
| K1
| K2
| 973
| 1.47
| 2.38
| 1 173
| 2.15
| 1.67
|
?
下列有关叙述正确的是(?)
A.b<0
B.在973 K下增大压强,K2增大
C.a>b
D.在常温下反应①一定能自发进行
参考答案:AC
本题解析:由题意知温度升高K1增大,K2减小,说明升温,反应①的平衡向右移动,反应②的平衡向左移动,所以①中正反应是吸热反应,a>0,②中正反应是放热反应,b<0,A对,C对;增大压强,两平衡均不移动,B错;反应①的ΔS的取值及符号不能确定,ΔH-TΔS不一定小于0,所以反应不一定自发进行,D错。
本题难度:一般
4、填空题 煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO (g) +H2O (g) H2 (g) +CO2 (g)平衡常数K随温度的变化如下表: H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:

回答下列问题
(1)该反应的平衡常数表达式K=?,ΔH=?0(填“<”、“>”、“=”)
(2)已在一定温度下,C(s) +CO2 (g) 2CO (g)平衡常数K1; 2CO (g)平衡常数K1;
C (s) +H2O(g) CO(g) +H2 (g)平衡常数K2则K、K1、K2,之间的关系是?: CO(g) +H2 (g)平衡常数K2则K、K1、K2,之间的关系是?:
(3)8000C时,向一个10L的恒容反应器中充入0.40molCO 91ExAm.org和1.60mol水蒸气,经一段时间后反应达到平衡,此时CO的转化率为?:若保持其他条件不变,向平衡体系中再通入0. 10molCO和0.40molCO2,此时v正?v逆 (填“>”、“=”或“<”)。
参考答案:(7分)(1) C(CO2)C(H2)/C(CO) C(H2O),(1分) ,< (1分);
(2) K=K2/K1?(1分)?(3)80% (2分);=(2分)
本题解析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,该反应的平衡常数表达式K=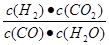 。根据表中的数据可知,随着温度的升高,平衡常数K是减小的,这说明升高温度平衡向逆反应方向进行,所以正方应是放热反应,即△H<0。 。根据表中的数据可知,随着温度的升高,平衡常数K是减小的,这说明升高温度平衡向逆反应方向进行,所以正方应是放热反应,即△H<0。
(2)根据盖斯定律可知,②-①即得到反应CO (g) +H2O (g) H2 (g) +CO2 (g),所以平衡常数之间的关系是K=K2/K1。 H2 (g) +CO2 (g),所以平衡常数之间的关系是K=K2/K1。
CO (g) +H2O (g) H2 (g) +CO2 (g) H2 (g) +CO2 (g)
起始浓度(mol/L)? 0.040? 0.16? 0? 0
转化浓度(mol/L)? x? x? x? x
平衡浓度(mol/L)? 0.040-x? 0.16-x? x? x
则根据该温度下的平衡常数可知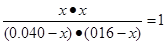
解得x=0.032mol/L
所以CO的转化率=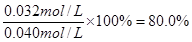
若保持其他条件不变,向平衡体系中再通入0. 10molCO和0.40molCO2,则此时CO、H2O、CO2、H2的浓度分别是(mol/L)0.018、0.128、0.072、0.032,所以Q=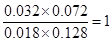 ,所以反应仍然是平衡状态,则正逆反应速率相等。 ,所以反应仍然是平衡状态,则正逆反应速率相等。
点评:该题是中等难度的试题,也是高考中的常见题型。试题针对性强,主要是考查学生对平衡常数含义、表达式以及有关应用的熟悉了解程度,旨在培养学生的逻辑思维能力和规范答题能力。在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。
本题难度:一般
5、选择题 体积相同的甲和乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 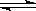 ?2SO3,并达到平衡,在该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为:(?) ?2SO3,并达到平衡,在该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为:(?)
A.等于p%
B.大于p%
C.小于p%
D.无法判断
参考答案:B
本题解析:略
本题难度:一般
|