1、选择题 下列粒子中,不会破坏水的电离平衡的是( )
A.CH3COOH
B.H+
C.OH-
D.Na+
2、填空题 (1)常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的比值关系为 。
(2)现有浓度均为0.1 mol/L的下列溶液:①氢氧化钡;②醋酸;③氢氧化钠;④盐酸,四种溶液中由水电离出的OH—浓度由大到小的顺序是(填序号) 。
(3)已知100℃ KW=10-12,若将此温度下pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积之比为 。
3、选择题 能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是( )
A.向水中投入一小块金属钠
B.将水加热煮沸
C.向水中通入二氧化碳气体
D.向水中加食盐晶体
4、填空题 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5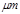 的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含离子的化学组分及其浓度如下表:
离子
| H+
| K+
| Na+
| NH4+
| SO42-
| NO3-
| Cl-
|
浓度/mol·L-1
| 未测定
| 4×10-6
| 6×10-6
| 2×10-5
| 4×10-5
| 3×10-5
| 2×10-5
|
根据表中数据判断试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1
C(s)+1/2O2(g)="CO" (g) △H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
A.Ca(OH) 2 B.Na2CO3 C.CaCl2D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化
① 若1mol空气含0.8molN2和0.2molO2,汽缸中的化学反应式为N2 (g)+O2(g)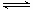 2NO(g) △H
2NO(g) △H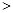 0
0
1300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是 。
②目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 。
③ 汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g)
已知该反应的△H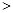 0,判断该设想能否实现并简述其依据: 。
0,判断该设想能否实现并简述其依据: 。
5、选择题 用标准盐酸溶液滴定待测浓度的碱溶液时,下列操作中会引起碱溶液浓度的测定值偏大的是
A.锥形瓶里溶液在滴定过程中溅出
B.锥形瓶用蒸馏水冲洗后未用待测液润洗
C.指示剂变色15 s后又恢复为原来的颜色便停止滴定
D.滴定管装液后尖嘴部位有气泡,滴定后气泡消失