1、选择题 下列物质有漂白性的是
[? ]
A.SO2水溶液
B.液氯
C.SO2与Cl2等摩尔混合后配成溶液
D.久置氯水
参考答案:A
本题解析:
本题难度:简单
2、选择题 实验现象是物质性质的反映,下列对实验现象的解释或由此得出的结论不正确的是( )
| 选项 | 实验 | 现象 | 解释或结论
A
将SO2通入Ba(NO3)2溶液中
溶液变浑浊并
产生气体
生产BaSO4沉淀和NO气体
B
向含有苯酚的苯溶液中滴入少量浓溴水
未见白色沉淀
生成的三溴苯酚又溶于苯中
C
点燃CO还原Fe2O3后的尾气
气体未能燃烧
CO已充分反应完全
D
取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液
溶液变红
不能说明X溶液中是否含有Fe2+
|
A.A
B.B
C.C
D.D
参考答案:C
本题解析:
本题难度:简单
3、选择题 将SO2通入到显红色的酚酞试液中,发现红色消失。出现这种现象的主要原因是SO2
[? ]
A.有漂白性
B.溶于水显酸性,与碱中和
C.有氧化性
D.有还原性
参考答案:B
本题解析:
本题难度:简单
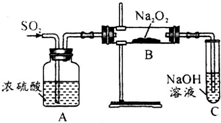
4、简答题 有两个实验小组的同学探究一氧化碳、二氧化硫与过氧化钠的反应.请回答下列问题:
(1)第一小组同学设计如图装置进行实验.通入SO2气体,将带余烬的木条插入试管C中,木条复燃.
甲同学认为Na2O2与SO2反应生成了Na2SO3和O2,则反应的化学方程式为______.乙同学认为Na2O:与SO2反应除了生成Na2SO3和O2外,还有Na2SO.生成.为检验是否有Na2SO4生成,该同学设计了如下方案:
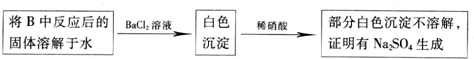
你认为乙同学的方案是否合理______(答“是”或“否”);请简要说明两点理由:
①______②______.
(2)第二小组同学利用下图中的有关装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应.已知:H2C204
CO2↑+CO↑+H2O若CO能够与Na2O2发生反应,则预测反应产物为______;验证该产物可选择的试剂是______.上述实验中选择的最简单的装置接口连接顺序为______.

参考答案:(1)Na2O2与SO2反应生成了Na2SO3和O2,结合得失电子守恒知,该反应方程式为:2Na2O2+2SO2=2Na2SO3+O2,在检验硫酸根离子前要排除亚硫酸根离子的干扰,亚硫酸根离子具有还原性,过氧化钠和硝酸都能把亚硫酸根离子氧化生成硫酸根离子,对硫酸根离子造成干扰,所以乙同学的方案不合理,
故答案为:2Na2O2+2SO2=2Na2SO3+O2;否;
①稀HNO3可以把BaSO3氧化为BaSO4;
②若反应后的固体有Na2O2残留,溶于水后可把SO32- 氧化为 SO42-;
(2)根据二氧化碳和过氧化钠反应生成碳酸钠知,一氧化碳和过氧化钠反应也生成碳酸钠,则一氧化碳和过氧化钠反应的预测产物为Na2CO3,碳酸盐和稀盐酸或稀硫酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊,所以为检验该产物可选择的试剂是稀H2SO4(或稀HC1)和澄清石灰水;为验证CO气体与Na2O2的反应,防止二氧化碳对其干扰,通入过氧化钠前需要除去二氧化碳,要用氢氧化钠溶液除去二氧化碳所以导气管的连接顺序为:abcf;
故答案为:Na2CO3;稀H2SO4(或稀HC1)和澄清石灰水;abcf.
本题解析:
本题难度:一般
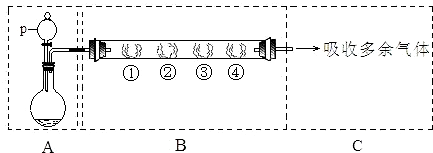
5、简答题 用如下装置可以完成一系列实验(图中夹持装置已略去).
请回答下列问题:
Ⅰ.若用装置A选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 | ① | ② | ③ | ④
所蘸试剂
石蕊试液
品红溶液
淀粉和碘水混合液
氢硫酸
现象
______
______
褪色
浅黄色
体现SO2的性质
______
______
______
______
|
II.若用装置A选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液.回答下列问题:
(1)p中盛装试剂为______.
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式______.①处包有的某固体物质可能是______.
a.MnO2?b.KMnO4?c.KCl?d.Cu
(3)在整个实验过程中,在③处能观察到______.
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:______.
参考答案:Ⅰ.SO2可溶于水生成亚硫酸(H2SO3),H2SO3显酸性,能使石蕊试液变红;
SO2具有漂白性,能使品红溶液褪色;
碘能使淀粉溶液变蓝,SO2具有还原性,能与碘水反应:SO2+I2+2H2O=H2SO4+2HI,溶液蓝色褪去;
SO2具有氧化性,能与氢硫酸反应:SO2+2H2S=3S+2H2O,
故答案为:
溶液变红溶液褪色水溶液显酸性漂白性还原性氧化性II.(1)因浓硫酸和浓盐酸混合时,为了使热量散发,应将浓硫酸缓慢加入到浓盐酸中,故答案为:浓硫酸;
(2)有棕黄色物质确定为单质碘,卤素单质间能发生置换反应:Cl2+2KI=2KCl+I2,因通过①后生成了Cl2,而KMnO4溶液能氧化HCl得到Cl2,所以某固体物质可能是KMnO4,故答案为:Cl2+2I-=2Cl-+I2;b;
(3)因Cl2能与水反应生成HCl和HClO,HCl具有酸性,能使石蕊溶液变红,HClO具有强氧化性能使红色褪去,故答案为:先变红后褪色;
(4)②处有棕黄色褪去,生成无色的IO3-,碘的化合价升高,则氯元素和化合价降低为-1价,化学方程式为:
5Cl2+I2+6H2O=2HIO3+10HCl,离子方程式为:5Cl2+I2+6H2O=12H++2IO3-+10Cl-,
故答案为:5Cl2+I2+6H2O=12H++2IO3-+10Cl-.
本题解析:
本题难度:一般