1、选择题 在硫酸铁溶液中,加入a g 铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是?
A.最后得到的溶液中不含有Cu2+
B.残余固体一定全部是铜
C.最后得到的溶液中只含Cu2+
D.残余固体可能为铁、铜混合物
参考答案:D
本题解析:由于b小于c,所以最终所得的固体一定含有铜,但也可能含有铁,因此选项D正确,其余都是错误的,答案选D。
本题难度:一般
2、填空题 (1)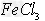 溶液常用于腐蚀印刷电路板,反应的离子方程式为________________。?
溶液常用于腐蚀印刷电路板,反应的离子方程式为________________。?
(2)向含有1?mol?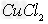 、2?mol?
、2?mol?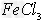 的腐蚀铜板后的混合液中加入铁粉n?mol,试分析溶液中阳离子的各种情况填入下表
的腐蚀铜板后的混合液中加入铁粉n?mol,试分析溶液中阳离子的各种情况填入下表
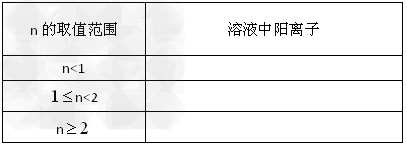
?(3)腐蚀铜板后的混合液中,若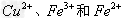 的浓度均为0.10
的浓度均为0.10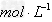 ?
?
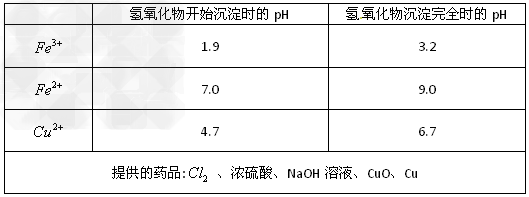
请参照下表给出的数据和药品,简述除去?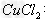 溶液中?
溶液中?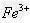 和?
和?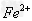 的实验步骤______________________。?
的实验步骤______________________。?
参考答案:(1)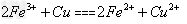 (2)
(2) (3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液pH至3.2 ~4.7;
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液pH至3.2 ~4.7;
③过滤〔除去Fe(OH)3〕
本题解析:
本题难度:一般
3、选择题 下列金属在一定条件下能够与水反应,且生成金属氧化物的是(?)
A.K
B.Mg
C.Fe
D.Cu
参考答案:C
本题解析:略
本题难度:简单
4、填空题 把等物质的量的Cu、Fe粉投入一定量的FeCl3溶液中充分反应后取出部分溶液,
(1)若滴加一滴KSCN溶液,溶液显红色,则溶液中存在的离子有_________。
(2)若加一滴KSCN溶液,溶液不显红色,则溶液中一定存在的离子有_________,可能存在的金属粉末有_________。
(3)若加入的金属全部溶解,则溶液中n(Cu2+):n(Fe2+)是_________。
(4)若(3)反应后的溶液中有3种金属离子,欲从中回收Cu和FeCl3,需要用到的试剂有(按反应顺序填写)___________________________________。
参考答案:(9分)(1)Cu2+、Fe2+、Fe3+、Cl-?(2)Fe2+、Cl-?;Fe 、Cu?(3)1:5
(4)Fe、稀盐酸、Cl2
本题解析:(1)若滴加一滴KSCN溶液,溶液显红色,说明一定含有铁离子,则铜和铁完全被氧化,因此溶液中存在的离子有Cu2+、Fe2+、Fe3+、Cl-。
(2)若加一滴KSCN溶液,溶液不显红色,说明溶液中不存在铁离子。由于铁的金属性强于铜的,所以铁首先被氧化,则溶液中一定存在的离子有Fe2+、Cl- ,可能存在的金属粉末有铁和铜。
(3)若加入的金属全部溶解,则根据反应式2Fe3++Fe=3Fe2+、2Fe3++Cu=2Fe2++Cu2+可知溶液中n(Cu2+):n(Fe2+)是1:5。
(4)要回收铜,则需要加入过量的铁粉,过滤后,再加入稀盐酸将过量的铁氧化,最后通入氯气将氯化亚铁氧化生成氯化铁,因此需要用到的试剂有(按反应顺序填写)Fe、稀盐酸、Cl2。
点评:该题是高考中的常见题型和考点,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确反应原理,然后结合题意灵活运用即可。
本题难度:一般
5、选择题 下列所用材料不属于合金的是
A.家用的铝窗
B.建筑用的钢筋
C.铸造用的黄铜
D.温度计用的水银
参考答案:D
本题解析:由2种或2种以上的金属或金属与非金属熔化而成的检验金属特性的物质是合金,据此可知选项D不是合金,而是金属单质,其余都是的,答案选D。
点评:该题是基础性试题的考查,也是高考中的常见考点,试题基础性强,侧重对学生基础知识的巩固和训练。该题的关键是明确合金的概念,然后灵活运用即可。
本题难度:简单