1、选择题 下列实验中,能够达到预期目的的是(? )
编号
| 实验内容
| 实验目的
|
A
| 在Na2SO3溶液中加入HNO3酸化的Ba(NO3)2 ,产生白色沉淀
| 检验Na2SO3是否变质
|
B
| 将某气体通入品红溶液中,品红褪色
| 证明该气体是SO2
|
C
| 用洁净的玻璃棒蘸取NaOH溶液,点在湿润的pH试纸上,与标准比色卡对照
| 测定NaOH溶液的pH
|
D
| 在两支试管中各加入4 mL? 0.01 mol/L的KMnO4 酸性溶液,再分别加入0.1 mol/L H2C2O4 溶液2 mL、0.2 mol/L H2C2O4 溶液2 mL, 分别记录溶液褪色所需时间
| 探究相同条件下,溶液浓度对反应速率的影响
参考答案:D
本题解析:A项:HNO3首先氧化Na2SO3成Na2SO4,Na2SO4再与Ba(NO3)2反应产生白色沉淀;B项:氯气也可以使品红溶液褪色;若将某气体通入品红溶液中,品红褪色,再加热颜色恢复,可证明该气体是SO2;C项:pH试纸使用时不用湿润。故选D。
点评:解答本题需主要学生对实验操作细节的掌握,要求学生平时注意基础知识的积累掌握(PH的使用前不能湿润。Na2SO3具有还原性,HNO3具有强氧化性)。
本题难度:简单
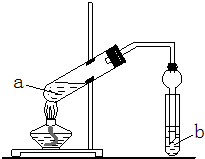
2、简答题 某同学为验证Fe能与热的浓HNO3反应,设计了如上图所示的实验装置,a中加入的是Fe片和浓HNO3,b加入的是NaOH溶液.请你参与研究并回答下列问题:
(1)当该同学实验结束时,铁完全溶解,试管液面上方为无色气体,试管上部为红棕色气体,此时用所得的溶液又进行如下试验和探究:
①在所得的溶液中加入一小块Cu片,结果Cu片先逐渐溶解,并伴随其他现象,反应一段时间后不再溶解.Cu片溶解的原因可能是______、
______(用离子方程式表示).
②请设计实验证明再加入Cu片不再溶解后的溶液中含有Fe2+但不含Fe3+.说明具体操作和实验现象______.
(2)若研究稀硝酸与铁的反应,要用浓硝酸进行配制.实验室有10mol/L的硝酸溶液,从中量出5.0mL,其物质的量浓度为______mol/L.现将量出的5.0mL硝酸溶液配制成0.50mol/L的稀硝酸,所需要的玻璃仪器除烧杯、玻璃棒外,还需要______和______.在配制过程中,定容时仰视,则所配溶液的浓度______(填“偏大”或“偏小”或“无影响”).
参考答案:(1)①反应后溶液中含有的Fe(NO3)3,稀HNO3能与铜片反应,离子方程式分别为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;Cu+2Fe3+=Cu2++2Fe2+;
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;Cu+2Fe3+=Cu2++2Fe2+;
②取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe2+但不含Fe3+;
故答案为:取适量反应后的溶液放入试管中,加入KSCN溶液无明显现象,再加入少量氯水,溶液变红则证明溶液中含有Fe2+但不含Fe3+;
(2)实验室有10mol/L 的硝酸溶液,从中量出5.0mL,其物质的量浓度仍然为10mol/L;
量取浓硫酸要用量筒和胶头滴管,稀释浓硫酸要用烧杯、玻璃棒,配制溶液要用100mL容量瓶,定容时要用胶头滴管滴加蒸馏水至液面与刻度线相切,
在配制过程中,定容时仰视,溶液的体积偏大,根据c=nV分析可知溶液浓度偏小;
故答案为:10;100mL容量瓶,胶头滴管;偏小;
本题解析:
本题难度:一般
3、实验题 (15 分)
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

制备苯乙酸的装置示意图如下(加热和夹持装置等略):
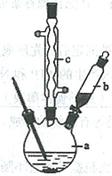
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
?。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是?;仪器c的名称是?,其作用是?。
反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是?。下列仪器中可用于分离苯乙酸粗品的是?(填标号)。
A.分液漏斗
B.漏斗
C.烧杯
D.直形冷凝管E.玻璃棒
|
(3)提纯粗苯乙酸的方法是?,最终得到44 g纯品,则苯乙酸的产率是?。
(4)用CuCl2? ? 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是?。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是?。
参考答案:
⑴先加水、再加入浓硫酸(1分)
⑵滴加苯乙腈(1分)球形冷凝管(1分) 回流(或使气化的反应液冷凝)(1分)
便于苯乙酸析出(2分) BCE(全选对2分)
⑶重结晶(1分)?95%( 2分)
⑷取少量洗涤液、加人稀硝酸、再加AgN03溶液、无白色浑浊出现(2分)
⑸增大苯乙酸溶解度,便于充分反应(2分)
本题解析:⑴蒸馏水与浓硫酸混合应先加水、再加入浓硫酸,防止暴沸。
⑵仪器b为分液漏斗,通过分液漏斗向三口瓶a中滴加苯乙腈;仪器c为球形冷凝管,能起到冷凝回流的作用(使气化的反应液冷凝);反应结束后加适量冷水,便于苯乙酸(微溶于冷水)结晶析出,通过过滤能从混合液中分离出苯乙酸粗品,过滤所用的仪器主要有漏斗、玻璃棒、烧杯等。
⑶将粗苯乙酸晶体重新在热水中溶解,然后再降温结晶过滤(重结晶)可得较纯净的苯乙酸晶体;根据“1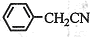 ~1
~1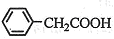 ”关系式,可计算苯乙酸的产率=
”关系式,可计算苯乙酸的产率=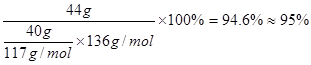 。
。
⑷在制备Cu(OH)2沉淀的同时还有可溶性NaCl生成,故判断沉淀洗干净的方法就是检验最后一次洗涤液中是否还含有Cl-。
⑸根据“苯乙酸微溶于冷水,溶于乙醇”,故乙醇与水的混合溶剂中的乙醇能增大苯乙酸的溶解度,便于充分反应。
本题难度:一般
4、实验题 金属钠与水的反应是中学化学中的一个重要反应。在高中化学教材的几次改版中该实验曾出现过几种不同的演示方法,分别如下图中甲、乙、丙所示
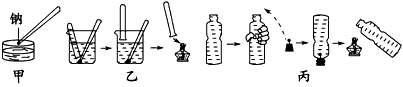
(1)现按图甲所示的方法,在室温时,向盛有Ca(HCO3)2溶液的水槽中加入一小块金属钠。下列现象描述正确的是________
A.钠浮在液面上,并四处游动,最后消失
B.钠熔化成一个光亮的小球
C.反应开始后,溶液由无色变红色
D.恢复到室温时,烧杯底部有固体物质析出
(2)请补充并完成甲实验中从试剂中取出钠到向水槽中投入钠的有关操作;用镊子从试剂中取出一块钠→
______________,用镊子夹取切好的金属钠投入到盛有Ca(HCO3)2溶液的烧杯中。
(3)某同学用镊子夹住一块钠,按图乙所示方法来收集产生的气体,但钠很快脱落,实验没有成功。正确的关键操作是_____________________。
(4)用装满水的矿泉水瓶按图丙方法进行实验,用手挤压矿泉水瓶并塞紧带有钠的塞子,排出水的体积共为16.8 mL,待钠反应结束后,干瘪的带塞矿泉水瓶恢复成原状,假设瓶内、瓶外均处于标准状况,则所用的钠的质量为_______g。
参考答案:(1)ABD
(2)用滤纸吸干表面的煤油,在玻璃片上用小刀切下绿豆大小的钠粒,并将多余的钠放回试剂瓶中
(3)用铝箔把钠包好后再扎上一些小孔,再用镊子夹住
(4)0.0345
本题解析:
本题难度:一般
5、实验题 向草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色总是先慢后快。某研究性学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验探究其原因:
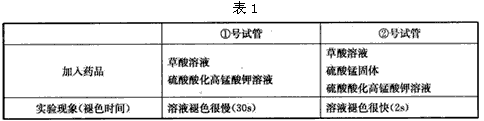
实验(1):在两支试管中分别加入10mL等浓度的草酸溶液,在②号试管中加入少量硫酸锰固体。然后在两支试管中分别加入5滴0. 1mol.L-1的硫酸酸化高锰酸钾溶液。现象如表1。
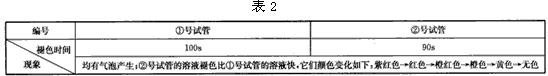
实验(2):在两支试管中分别加入5mL等浓度的草酸溶液,在②号试管中再滴加10滴稀硫酸,然后各加入5 滴0. 1mol.L-1的高锰酸钾溶液。现象如表2。
实验(3):取3支试管分别加入5mL等浓度草酸溶液,然后在①、②、③号试管中依次加入10滴、1mL、2mL稀硫酸溶液,各加入5滴0. 1mol.L-1的高锰酸钾溶液,然后置于温度为65℃的水浴中加热。观察现象如表3。

(1)该研究性学习小组的实验目的是___。
(2)该研究性学习小组进行实验时所用的方法是科学实验中常用的一种方法,该方法叫____法;
(3)实验(1)得出的结论是____。
(4)由实验(2)和实验(3)得出的结论是(写三点)____,____,____?
(5)据有关现象写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:
___H2C2O4+___MnO4-+____H+==____Mn2++____CO2↑+___H2O
参考答案:(1)研究温度、浓度、催化剂等因素对化学反应速率的影响
(2)对照实验法或者控制变量法
(3) Mn2+在反应中起到催化剂的作用,加快了反应速率
(4)加入少量硫酸,可以促进草酸和高锰酸钾溶液的反应;加入大量硫酸,草酸和高锰酸钾溶液的反应速率比较慢;温度升高,反应速率加快
(5)5 ;2; 6 ;2 ;10; 8
本题解析:
本题难度:一般