1、选择题 已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是

?
| ①
| ②
| ③
| ④
|
A
| 黄绿色
| 橙色
| 蓝色
| 无色
|
B
| 无色
| 橙色
| 紫色
| 白色
|
C
| 黄绿色
| 橙色
| 蓝色
| 白色
|
D
| 黄绿色
| 无色
| 紫色
| 白色
|
?
参考答案:C
本题解析:略
本题难度:一般
2、选择题 目前,很多自来水厂用氯气杀菌、消毒。下列关于氯气的性质描述不正确的是?
A.无色
B.有毒
C.黄绿色
D.有刺激性气味
参考答案:A
本题解析:氯气是黄绿色、有毒、有刺激性气味的气体,所以描述错误的是A。
本题难度:简单
3、填空题 氯气及其化合物在工农业生产和人类生活中都有着重要的应用。?
(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有__________性,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式____________________。
(2)棕黄色强刺激性气体Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,配平并补充完整下列反应方程式:
______Cl2+_______Na2CO3+________=_______NaHCO3+____NaCl+____ Cl2O
(3)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为__________。
②ClO2遇浓盐酸会生成Cl2,每生成1mol Cl2转移电子的物质的量为__________。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为_________________。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
已知:①上述反应中,4mol HCl被氧化放出115.6kJ的热量。
②
则断开1 mol H-O键与断开1 mol H-Cl键所需能量相差约为_________kJ,H2O中
H—O键比HC1中H—Cl键(填“强”或“弱”)__________。
参考答案:(14分)(1)强氧化性(1分)? Cl2+2OH-=ClO-+Cl-+H2O(2分)
(2)2? 2? H2O? 2? 2? 1(水分子1分,系数1分,共2分)
(3)①2ClO-+SO2=2ClO2+SO42-(2分)?②1.6mol(2分)?③2:5(2分)
(4)32(2分)?强(1分)
本题解析:(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有强氧化性。氯气能被氢氧化钠溶液吸收,所以工业上用氯气和NaOH溶液生产消毒剂NaClO,有关反应的离子方程式是Cl2+2OH-=ClO-+Cl-+H2O。
(2)根据物质的化学式可知,反应前后元素化合价发生变化的是氯元素。其中部分氯元素的化合价从0价升高到+1价,部分降低到-1价,所以根据电子的得失守恒可知,还原剂和氧化剂的物质的量之比是2:1.根据原子守恒可知,反应前还有水参加,所以配平后的方程式是2 Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O.
(3)①KClO3与SO2在强酸性溶液中反应可制得ClO2,在反应中SO2被氧化生成硫酸钾,所以此反应的离子方程式为2ClO-+SO2=2ClO2+SO42-。
②ClO2遇浓盐酸会生成Cl2,则该反应的化学方程式是2ClO2+8HCl(浓)=4H2O+5Cl2↑。根据方程式可知反应中转移电子的个数是8个,所以每生成1mol Cl2转移电子的物质的量为8mol÷5=1.6mol。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-。在反应中氯元素的化合价从+4价降低到-1价,得到5个电子。Mn元素的化合价从+2价升高到+4价,失去2个电子,所以根据电子的得失守恒可知,该反应过程中氧化剂与还原剂的物质的量之比为2:5。
(4)设断开1 mol H-O键与断开1 mol H-Cl键所需能量分别是x与y,由于反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据题意可知4y+498kJ-2×243 kJ-4x=-115.6 kJ,解得x-y=32 kJ,因此H2O中H—O键比HC1中H—Cl键强。
本题难度:一般
4、填空题 (10分)如图,取一块黄豆大小的金属钠放在石棉网上,用酒精灯预热,待钠熔成球状时,将盛氯气的集气瓶倒扣在钠的上方,钠会在氯气中剧烈燃烧,产生大量白烟,请回答下列问题:
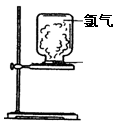
(1)对此反应及现象的描述正确的是?
A.此反应为放热反应
B.白烟的生成说明产生了氯化钠分子
C.反应中钠元素被氧化,氯元素被还原。
(2)写出该反应的方程式?
(3)用电子式表示氯化钠的形成过程?,
(4)检验有Cl-生成,请补充实验步骤(可填满也不可填满)
①倒转集气瓶,加适量蒸馏水
②取少量溶液于试管中。
③加试管中加入?。
④有?生成则证明有Cl-。
参考答案:(1)AC?(2)2Na+Cl2="=2NaCl" (点燃)
(3)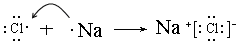
(4)硝酸银(或答硝酸酸化的硝酸银)、白色沉淀
本题解析:氯气具有强氧化性,钠是活泼的金属,二者化合生成氯化钠,属于放热反应。氧化钠是离子化合物,不是分子,其形成过程为 。B是错误的。答案选AC;检验氯离子一般用硝酸酸化的硝酸银,现象是产生白色沉淀。
。B是错误的。答案选AC;检验氯离子一般用硝酸酸化的硝酸银,现象是产生白色沉淀。
本题难度:简单
5、选择题 下列关于实验中颜色变化的叙述正确的是( )
A.将二氧化硫通入品红溶液中,溶液显红色,加热后变为无色
B.向溶液中加入新制氯水,再滴加KSCN溶液,若溶液变红色,则证明溶液中一定含有Fe2+
C.将湿润的红纸条放进盛有氯气的集气瓶中,红纸条褪色
D.用标准高锰酸钾溶液滴定Na2SO3溶液,终点时溶液由紫色变为无色
参考答案:A、二氧化硫遇品红溶液使之褪色,加热后复原,故A错误;
B、该操作不能排除原溶液中是否含有三价铁离子,故B错误;
C、氯气与水反应生成次氯酸,次氯酸有漂白性,能使有色布条褪色,所以将湿润的红纸条放进盛有氯气的集气瓶中,红纸条褪色,故C正确;
D、当Na2SO3被消耗完毕时,再滴加高锰酸钾溶液则出现紫色,所以终点时溶液由无色变为紫色,故D错误;
故选C.
本题解析:
本题难度:简单