1、选择题 25℃时在五份蒸馏水中分别加入适量的下列物质,所得实验结果如下表所示:

加入物质后水的电离程度由大到小排列顺序正确的是
[ ? ]
A.α3>α1>α5>α4>α2
B.α4>α2>α5>α3>a1
C.α2>α4>α5>α1>α3
D.α1>α3>α5>α2>α4
参考答案:B
本题解析:
本题难度:一般
2、填空题 (6分)①常温下,0.05mol/L硫酸溶液中,C(H+)= mol/L,
水电离的C(H+)= mol/L
②某温度,纯水中C(H+)==3×10-7mol/L,则:
纯水中C(OH-)="=" mol/L,此时温度 (填“高于”“低于”或“等于”)25℃。若温度不变,滴入盐酸后C(H+)=5×10-4mol/L,
则溶液中C(OH-)= mol/L,由水电离的C(H+)="=" mol/L。
参考答案:
本题解析:略
本题难度:一般
3、填空题 往20mL硫酸和盐酸的混合溶液中,加入0.05mol/LBa(OH)2溶液时,生成BaSO4的量和溶液的pH变化如右图。试回答:
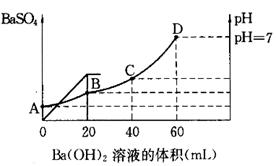
(1)起始时,混酸中H2SO4的物质的量浓度为
(2)起始时,混酸中盐酸的物质的量浓度为
(3)B点时溶液的pH是 。
参考答案:(1)0.05mol/L (2)0.2mol/L (3)1
本题解析:(1)根据图像可知,当加入20ml氢氧化钡时,沉淀达到最大值,所以硫酸的物质的量是0.02L×0.05mol/L=0.001mol,则硫酸的浓度是0.001mol÷0.02L=0.05mol/L。
(2)当Ph=7是,酸碱恰好中和,则盐酸的物质的量是2×0.04L×0.05mol/L=0.004mol,则盐酸的浓度是0.004mol÷0.02L=0.2mol/L。
(3)B点相当于是硫酸被中和,则溶液中氢离子的浓度是 ,所以pH=1。
,所以pH=1。
考点:考查酸碱中和的有关判断以及pH的有关计算
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练。旨在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确图像的变化趋势特点,然后结合题意灵活运用即可。
本题难度:一般
4、填空题 (6分)一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸(用a、b、c回答)。
(1)当其物质的量浓度相同时。c(H+)由大到小的顺序是 ,pH由大到小的顺序是 。
(2)同体积、同物质的量浓度的三种酸溶液,中和NaOH的能力由大到小的顺序是 。
参考答案:(1)b>a>c; c>a>b (2) b>a=c
本题解析:(1)当浓度相同的时候硫酸电离出来的H+最多,因为硫酸是二元强酸,醋酸电离出来的H+最少,因为醋酸是一元弱酸,所以c(H+)由大到小的顺序是b>a>c,H+浓度越大,酸性越强,pH越小,所以pH由大到小的顺序是c>a>b。(2)同体积、同物质的量浓度的三种酸溶液,由于盐酸和醋酸是一元酸它们所能够提供的H+的物质的量相等,所以消耗的NaOH溶液的体积相等,硫酸是二元酸,提供的H+更多,反应消耗的NaOH溶液的体积更多,故中和NaOH的能力由大到小的顺序是b>a=c
考点:强弱电解质的电离的理解。
本题难度:一般
5、选择题 相同条件下,等体积、等pH的醋酸溶液和盐酸溶液加水稀释相同的倍数后,所得溶液的pH
A.仍相同
B.醋酸溶液的大
C.盐酸的大
D.无法判断