1、填空题 (8分)⑴ 现有0.1mol·l-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作 。
⑵ 欲使0.1mol-1Na2CO3溶液中c(Na+)=2 c(CO32-),应采取的措施是 ( )
A.加少量盐酸 B.加适量的KOH C.加适量的水 D.加适量的NaOH
⑶ 为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是( )
A.甲同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。
B.乙同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。
C.丙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。
D.丁同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的。
⑷ 为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案。
2、选择题 现有浓度为1mol/L的五种溶液:①HCl,②H2SO4,③CH3COOH,④NH4Cl ⑤NaOH,由水电离出的C(H+)大小关系正确的是
[? ]
A.④>③>①=⑤>②
B.①=②>③>④>⑤
C.②>①>③>④>⑤
D.④>③>①>⑤>②
3、实验题 (15分)草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4·7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:

已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
金属离子
| 开始沉淀的pH
| 沉淀完全的pH
|
Fe3+
| 1.1
| 3.2
|
Fe2+
| 5.8
| 8.8
|
Al3+
| 3.0
| 5.0
|
Ni2+
| 6.7
| 9.5
|
②Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9。
(1)“粉碎”的目的是 。
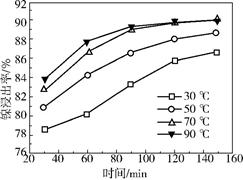
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如右图。“酸浸”的适宜温度与时间分别为 (填字母)。
a.30℃、30min
b.90℃、150min
c.70℃、120min
d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是 。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110 ℃下烘干,得草酸镍晶体。
①用乙醇洗涤的目的是。
②烘干温度不超过110℃的原因是。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”, ,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步: ,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)。
②第2步中加入适量NH4F溶液的作用是 。
4、选择题 25?℃时,水的电离达到平衡:H2O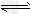 H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
[? ]
A.向水中加入稀氨水,水的电离程度增大
B.向水中加入少量固体醋酸钠,平衡逆向移动,c(H+)降低
C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
D.将水加热,平衡逆向移动
5、选择题 取浓度相同的Na0H和HCl溶液,以3∶2 体积比相混合,所得溶液的pH 等于12,则原溶液的浓度为 ( )
A.0.01mol/L
B.0.017mol/L
C.0.05mol/L
D.0.50mol/L