1、选择题 短周期元素A、B、C、D的核电荷数依次增大,最外层电子数之和为20,A和C、B和D分别属于同主族元素,C的最外层电子数是次外层电子数的一半。下列叙述错误的是?
A.A、C的单质和氧化物均为原子晶体? B.A和D可形成直线型分子
C.原子半径C>D>B? D.B的氢化物的沸点较D的高
参考答案:A
本题解析:C的最外层电子数是次外层电子数的一半,则C可能是Li或Si,短周期元素A、B、C、D的核电荷数依次增大,最外层电子数之和为20,所以C只能是Si,即得A为C,B为O,D为S。
A错,碳单质有金刚石(原子晶体)、石墨(过渡晶体)、C60(分子晶体);碳的氧化物有CO、CO2均为分子晶体;硅单质为原子晶体,二氧化硅为原子晶体;
B正确,A和D可形成CS2,CS2的结构与CO2相同,均为直线形结构。
C正确,同周期从左到右原子半径逐渐减小,同主族从上到下原子半径逐渐增大;
D正确,B的氢化物为H2O,D的氢化物为H2S,水分子间存在氢键,而H2S分子间不存在氢键。
本题难度:一般
2、选择题 X是第三周期非金属元素,该原子如果要达到8电子稳定结构,需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是
A.X最高价氧化物对应的水化物不一定是强酸
B.X元素的氢化物化学式一定为H2X
C.X的单质—定是良好的半导体材料
D.X元素的氧化物—定能与烧碱反应
参考答案:AD
本题解析:根据已知位、构、性方面的信息推断,X为Si或S。最高价氧化物对应的水化物为H2SiO3或H2SO4,前者是弱酸,后者是强酸,故A正确;气态氢化物为SiH4或H2S,故B错误;单质为Si或S,前者是半导体材料,后者是绝缘体材料,故C错误;氧化物为SiO2或SO2、SO3,都是酸性氧化物,故D正确。
本题难度:一般
3、填空题 (5分)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(1)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式?▲?;
(2)Be(OH)2与Mg(OH)2可用__▲___试剂鉴别,其反应离子方程式为?▲?。
(3)Li和Mg根据对角线规则,性质也相似,则Li在空气中燃烧,主要产物的化学式是__▲____;同时还有少量??▲?生成。
参考答案:各1分?共5分?

本题解析:略
本题难度:一般
4、推断题 五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是?,非金属性最强的是?(填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是?(用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为?,其中存在的化学键类型为?;
(4)D最高价氧化物的水化物的化学式为?;
(5)单质D在充足的单质E中燃烧,反应的化学方程式为?;D在不充足的E中燃烧,生成的主要产物的化学式为?;
(6)单质E与水反应的离子方程式为?。
参考答案:
(1)Na(1分)? Cl (1分)?
(2)PH3(2分)
(3)NH4Cl(2分)离子键和共价键(2分)
(4)H3PO4(2分)?
(5)2P+5Cl2 2PCl5(2分)? PCl3(1分)
2PCl5(2分)? PCl3(1分)
(6)Cl2+H2O=H++Cl-+HClO(2分)
本题解析:由题干信息知,本题突破口为:①五种元素为短周期,且原子序数依次增大,②A和B、D、E均能形成共价型化合物,③A和B形成的化合物在水中呈碱性(NH3),可推知A为H元素;B为N元素;根据A和C;B和D同族;且C离子与B离子具有相同的电子层结构;可推知C为Na元素;D为P元素;又知C和E形成的化合物在水中呈中性,所以E为Cl元素。
(1)五种元素中原子半径最大是Na,非金属性最强的是Cl;
(2)由H 和N、P、Cl形成的共价化合物分别是NH3、PH3、HCl,因P的非金属性最差,所以PH3的热稳定性最差。
(3)NH3+HCl=NH4Cl,产物的化学式为NH4Cl,其化学键为离子键、共价键。
(4)P为ⅤA元素,其最高价氧化物的水化物为:H3PO4。
(5)P在足量的Cl2中燃烧生成PCl5,Cl2不足时生成PCl3
(6)Cl2与水反应的离子方程式一定要注意HClO是弱酸不拆,考生易写错。
【考点定位】本题信息量较多,属较简单的元素推断题。重点是对短周期常见元素(如:H、N、P、Cl等)及其化合物基础知识的考查。难度较低。
本题难度:一般
5、填空题 (6分)短周期元素ABCD原子序数依次增大。A元素原子核内无中子;B元素原子核外最外层电子数是次外层电子数的2倍;C元素是地壳含量最多的元素;D在短周期元素中金属性最强。请回答:
(1)B在元素周期表中的位置是?。
(2)A与C可形成10电子分子,其化合物类型为?(填“离子”或“共价”)化合物。
(3)A与C还可以形成一种18电子分子,向其溶液中加入少量二氧化锰粉末,反应的化学方程式为?。
(4)D与C按原子个数比为1:1组成的化合物与BC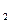 反应的化学方程式为
反应的化学方程式为
?。
参考答案:(6分)
(1)第二周期IV A族(1分)?(2)共价;(1分)
(3)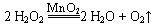 ?(2分)
?(2分)
(4)2Na2O2+2CO2=2Na2CO3+O2(2分)
本题解析:略
本题难度:简单