1、选择题 氯元素 的相对原子质量为35.5,由23Na、35Cl、37Cl构成的11.7g氯化钠中,37Cl的质量为
的相对原子质量为35.5,由23Na、35Cl、37Cl构成的11.7g氯化钠中,37Cl的质量为
A.1.75g? B.1.85 g? C.5.25 g? D .5.85g
.5.85g
参考答案:B
本题解析:略
本题难度:一般
2、选择题 下列物质中属于纯净物的是?
①由同种元素组成的物质 ②具有固定熔沸点的物质③由相同种类和相同数目的原子组成的分子 ④只有一种元素的阳离子和另一种元素的阴离子组成的物质 ⑤在氧气中燃烧只生成二氧化碳的物质 ⑥分子式为C3H6O2的有机物
A.②③
B.④⑤
C.①④
D.②⑥
参考答案:A
本题解析:①错,如金刚石与石墨等互为同素异形的物质;②正确;③正确;④错,如一种元素的阳离子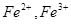 ;⑤错,如C和CO的混合气体等;⑥错,可以是甲酸乙酯和乙酸甲酯的混合物等;
;⑤错,如C和CO的混合气体等;⑥错,可以是甲酸乙酯和乙酸甲酯的混合物等;
本题难度:一般
3、选择题 美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如右图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成。“纳米车”可以用来运输单个的有机分子。下列说法正确的是

A.C60是一种新型的化合物
B.“纳米车”诞生说明人类操纵分子的技术进入了一个新阶段
C.人们用肉眼可以清晰看到“纳米车”的运动
D.C60与12C是同位素
参考答案:B
本题解析:由不同种元素形成的纯净物是化合物,A不正确,C60是一种单质;人的肉眼是看不见nm级材料的,C不正确;质子数相同,中子数不同的同一种元素的不同核素互称为同位素,C60是单质,不是核素,D不正确,答案选B。
点评:该题从表面看较难,题干新颖,但落点是很低的,属于基础性试题,难度不大。
本题难度:一般
4、选择题 下列各组物质的性质比较,不正确的是
A.酸性:
B.氢化物稳定性: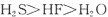
C.碱性: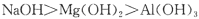
D.氧化性: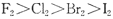
参考答案:B
本题解析:略
本题难度:简单
5、填空题 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、0四种元素的电负性由小到大的顺序为_____________________。
②下列叙述不正确的是_____________。(填字母)
A.因为HCHO与水分子间能形成氢键,所以HCHO易溶于水
B.HCHO和CO2分子中的中心原子均采用 杂化
杂化
C.C6H6分子中含有6个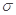 键和1个大
键和1个大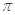 键,C2H2是非极性分子
键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是__________。
②六氰合亚铁离子[Fe(CN)6] 中不存在______________________________________。
中不存在______________________________________。
A.共价键? B.非极性键? C.配位键? D.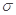 键? E.
键? E.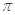 键
键
写出一种与CN-互为等电子体粒子的分子式_____________________。
(3) SO3分子的立体构型为_____________,SeO32-的立体构型为_______________。
参考答案:(1)①? H<C<N<O?②? B C(每空2分)
(2)①分子或离子应有孤对电子(3分)②? B? (2分)? CO?(2分)
(3)平面正三角形?三角锥形?(每空2分)
本题解析:(1)①根据电负性的判断依据,H、C、N、0的电负性的大小顺序为H<C<N<O;②能形成氢键的元素是N、O、F,所以水与HCHO能形成氢键,正确;B、CO2分子中的中心原子采取sp杂化,错误;C、C6H6分子中含有12个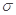 键,错误;D、CO2晶体属于分子晶体,二氧化硅属于原子晶体,所以CO2晶体的熔点、沸点都比二氧化硅晶体的低,正确;答案选BC。
键,错误;D、CO2晶体属于分子晶体,二氧化硅属于原子晶体,所以CO2晶体的熔点、沸点都比二氧化硅晶体的低,正确;答案选BC。
(2)①形成配合物的条件是一方提供空轨道,另一方提供孤对电子,所以与Fe原子或离子形成配合物的分子或离子应具备的结构特征是分子或离子中应有孤对电子②六氰合亚铁离子[Fe(CN)6] 中亚Fe2+与CN-形成配位键,C与N之间形成1个
中亚Fe2+与CN-形成配位键,C与N之间形成1个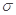 键、2个
键、2个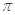 键,所以六氰合亚铁离子[Fe(CN)6]
键,所以六氰合亚铁离子[Fe(CN)6] 中不含非极性共价键,答案选B。等电子体是指原子总数和价电子总数均相同的微粒,CN-是2原子、10个价电子的粒子,与CN-互为等电子体粒子的有N2、CO等
中不含非极性共价键,答案选B。等电子体是指原子总数和价电子总数均相同的微粒,CN-是2原子、10个价电子的粒子,与CN-互为等电子体粒子的有N2、CO等
(3)SO3分子的价层电子对为3+1/2(6-3×2)=3+0,所以SO3分子的立体构型为平面正三角形,SeO32-的价层电子对为3+1/2(6+2-3×2)=3+1=4,所以SeO32-的立体构型为三角锥型
本题难度:一般