1、选择题 红磷(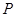 )和
)和 发生反应生成
发生反应生成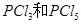 ,反应过程和能量关系如下图所示,图中的△H表示生成
,反应过程和能量关系如下图所示,图中的△H表示生成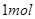 产物的数据。已知
产物的数据。已知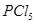 分解生成
分解生成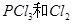 ,该分解反应是可逆反应,下列说法正确的是
,该分解反应是可逆反应,下列说法正确的是

A.其他条件不变,升高温度有利于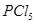 的生成
的生成
B.反应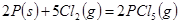 对应的反应热
对应的反应热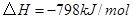
C.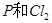 反应生成
反应生成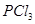 的热化学方程式为:
的热化学方程式为: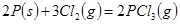
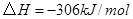
D.其他条件不变,对于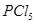 分解生成
分解生成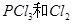 的反应,增大压强,
的反应,增大压强,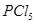 的转化率减小,平衡常数K减小
的转化率减小,平衡常数K减小
参考答案:B
本题解析:略
本题难度:一般
2、填空题 (14分)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡?移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡?移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)一氧化碳在高温下与水蒸气反应的方程式为:CO+H2O=CO2+H2。已知部分物质燃烧的热化学方程式如下: 2H2 (g) + O2(g) = 2H2O(l);△H=-571.6kJ·mol-1
2CO (g) + O2(g) = 2CO2?(g) ;△H=-566kJ·mol-1
?又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CO和水蒸气在高温催化剂下反应的热化学方程式?。
(3)在25℃下,向浓度为0.1 mol·L-1的AlCl3溶液中逐滴加入氨水,生成该沉淀的离子方程式为______________________________。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式?。
(5)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=1的H2SO4溶液VaL与pH=11的NaOH溶液VbL混合,若所得混合液为中性,则
Va︰Vb=?。
(6)在25℃下,将a mol·L-1的氨水 与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);
与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”);
参考答案:(14分)(1)向左; 不改变(各2分)
(2)CO(g)+H2O(g)=CO2(g)+3H2(g);△H=-41. 2kJ·mol-1(2分)
(3)3NH3·H2O+Al3+=Al(OH)3↓+3NH4+;(2分)
(4)N2+8H++6e-=2NH4+(2分)
(5)1 ︰ 10(2分)?(6)中(2分);
本题解析:略
本题难度:简单
3、选择题 关于某一化学反应的熵变,下列说法正确的是(?)
A.△S为反应产物总熵与反应物总熵之差
B.△S与S一样随温度变化不大
C.凡是熵增加的反应一定能自发进行
D.在温度、压强一定的条件下,焓变和熵变共同决定化学反应进行的方向
参考答案:AD
本题解析:熵是与物质混乱度有关系的物理量,选项A正确。熵值以及熵变都是和温度有关系的,B不正确;熵增加的反应不一定能自发进行,选项C不正确;反应的自发性由焓变和熵变共同决定,即满足△G=△H-T·△S,选项D正确,因此正确的答案选AD。
点评:该题是基础性试题的考查,侧重对教材基础知识的巩固和训练,意在提高学生灵活运用基础知识解决实际问题的能力,难度不大,记住即可!
本题难度:简单
4、选择题 下列反应中,既属于氧化还原反应又属于吸热反应的是(? )
A.锌与硫酸反应制取氢气
B.高温条件下碳粉与二氧化碳的反应
C.高温煅烧石灰石
D.Ba(OH)2·8H2O晶体与NH4Cl固体反应
参考答案:B
本题解析:从化合价有没有改变可排除C、D,而金属与酸置换氢气的反应为放热反应,而答案为B
本题难度:一般
5、填空题 (7分)在研究化学反应中的能量变化时,我们通常做下面的实验:
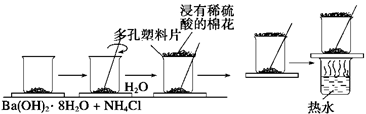
在一个小烧杯里,加入20 g已研磨成粉末的Ba(OH)2·8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10 g NH4Cl晶体,根据实验步骤,填写下表,并回答问题。
实验步骤
| 实验现象及结论
|
将晶体混合,立即快速搅拌
| 有刺激性气味能使湿润的紫色石蕊试纸变蓝的___①__产生
|
用手摸烧杯下部
| 感觉烧杯变凉说明此反应是_ ②?反应
|
用手拿起烧杯
| 烧杯下面的带有几滴水的玻璃片粘到了烧杯底部
|
将粘有玻璃片的烧杯放在盛有热水的烧杯上
| 玻璃片脱离上面烧杯底部
|
反应后移走多孔塑料片观察反应物
| 混合物成糊状,证明有_③___生成
|
(1)写出题目中①②③填入的内容
①?②?③?
(2)实验中要立即用玻璃棒迅速搅拌的原因是: __________________。(2分)
(3)在上述实验过程中,为什么用浸有稀硫酸的湿棉花置于多孔塑料板上?(2分)
___________________________________________________________。
参考答案:(1)① NH3;②吸热;③水;
(2)使反应物迅速混合而充分反应,使温度迅速下降;
(3)反应过程中产生对人体有害的气体,会对环境造成污染,故应用浸有稀H2SO4的棉花覆盖在多孔塑料片上来吸收产生的NH3。
本题解析:(1)Ba(OH)2?8H2O与NH4Cl反应的化学方程式为:BaCl2?8H2O+2NH4Cl═BaCl2+2NH3?H2O+8H2O;①将晶体混合,立即快速搅拌,Ba(OH)2?8H2O与NH4Cl反应生成了有刺激性气味能使湿润的紫色石蕊试纸变蓝的氨气;②用手摸烧杯下部,会感觉到烧杯变凉,说明该反应为吸热反应;③反应后移走多孔塑料片观察反应物,混合物成糊状,说明Ba(OH)2?8H2O与NH4Cl的反应中有水生成;(2)为了使反应物迅速混合而充分反应,使温度迅速下降,从而使反应现象更加明显,所以实验中要立即用玻璃棒迅速搅拌;(3)该反应中有氨气生成,氨气对人体有害的气体,会对环境造成污染,答案为:反应过程中产生对人体有害的气体,会对环境造成污染,故应用浸有稀H2SO4的棉花覆盖在多孔塑料片上来吸收产生的NH3。
本题难度:一般