1、填空题 (2分)已知:下列两个热化学方程式:
Fe(s) + 1/2O2(g)  ?FeO(s)?
?FeO(s)?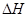 =-272.0KJ/mol
=-272.0KJ/mol
2Al(s) + 3/2O2(g)  Al2O3(s) ?
Al2O3(s) ?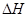 =-1675.7KJ/mol
=-1675.7KJ/mol
则 Al(s)的单质和FeO(s)反应的热化学方程式是______________________________________________________ 。
参考答案:3FeO(s) + 2Al(s)  Al2O3(s) + 3Fe(s)?
Al2O3(s) + 3Fe(s)?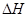 =-859.7KJ/mol?(2分)
=-859.7KJ/mol?(2分)
本题解析:考查盖斯定律的应用。根据反应①Fe(s) + 1/2O2(g)  ?FeO(s)和反应②2Al(s) + 3/2O2(g)
?FeO(s)和反应②2Al(s) + 3/2O2(g)  Al2O3(s)可知,②-①×3即得到3FeO(s) + 2Al(s)
Al2O3(s)可知,②-①×3即得到3FeO(s) + 2Al(s)  Al2O3(s) + 3Fe(s),所以反应热=-1675.7KJ/mol+272.0KJ/mol×3=-859.7KJ/mol。
Al2O3(s) + 3Fe(s),所以反应热=-1675.7KJ/mol+272.0KJ/mol×3=-859.7KJ/mol。
本题难度:简单
2、填空题 某同学进行如下实验,检验化学反应中的能量变化.
实验中发现反应前后①中的温度升高而②中的温度降低,由此判断Al与盐酸的反应是______热反应、Ba(OH)2?8H2O与NH4Cl的反应是______热反应.试写出①中反应的离子方程式:______.
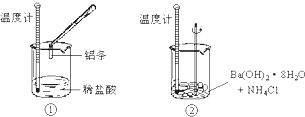
参考答案:通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低,根据温度升高,反应放热,温度降低,反应吸热,所以Al跟盐酸的反应是放热反应,Ba(OH)2?8H2O跟NH4Cl的反应是吸热反应,Al跟盐酸反应方程式为:2Al+6HCl═2AlCl3+3H2↑,则离子方程式为:2Al+6H+═2Al3++3H2↑,
故答案为:放;吸;2Al+6H+═2Al3++3H2↑.
本题解析:
本题难度:一般
3、选择题 下列有关叙述正确的是
A.如图所示,测定中和热时,大小两烧杯间填满碎纸的作用只是固定小烧杯

B.若用50mL 0.55mo1·L—1的氢氧化钠溶液,分别与50mL 0.50mo1·L—1的盐酸和50mL 0.25mo1·L—1的硫酸充分反应,两反应测定的中和热不相等
C.在中和滴定实验中,滴定管用蒸馏水洗涤后,再用标准液润 洗,再加进标准液
D.进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化
参考答案:C
本题解析:
正确答案:C
A、不正确,起隔热作用;B、不正确,中和热是生成1molH2O放出的热量,应相等;C、正确,减小误差;D、不正确,眼睛要始终注视锥形迸内溶液颜色的变化
本题难度:一般
4、选择题 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2均为正值):
H2(g)+Cl2(g)=2HCl(g) △H=-Q1kJ. mol-1
H2(g)+Br2(g)=2HBr(g) △H=-Q2kJ. mol-1
有关上述反应的叙述正确的是
[? ]
A.Q1>Q2
B.1mol HBr(g)具有的能量大于1mol HBr(1)具有的能量
C.生成1molHCl气体时放出Q1kJ热量
D.生成物总能量均高于反应物总能量
参考答案:AB
本题解析:
本题难度:一般
5、选择题 下列与化学反应能量变化相关的叙述正确的是(?)
A.生成物的总能量一定低于反应物的总能量
B.吸热反应一定需要加热才能发生
C.加快化石燃料的开采与使用,有利于节能减排,保护环境
D.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
参考答案:D
本题解析:反应是放热反应还是吸热反应,与反应条件无关系,只与反应物总能量和生成物总能量的相对大小有关系。如果反应物的总能量高于生成物的总能量,反应就是放热反应,反之是吸热反应,因此选项AB不正确。化石燃料的含量是有限的,并能无限制的开采,且化石燃料燃烧溶液导致环境污染,C不正确,所以正确的答案选D。
点评:该题是基础性试题的考查,侧重对学生教材基础知识的检验,旨在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确放热反应和吸热反应的含义以及判断依据,并能灵活运用即可。有利于培养学生的环境保护意识和能源节约意识。
本题难度:一般