1、选择题 常温下,Ksp(CaSO4)=9×10-6,CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是

[? ]
A.温度升高,化学平衡常数K、电离常数Ka、难溶电解质的 溶度积常数Ksp均增大
B.a点对应的Ksp等于c点对应的Ksp
C.b点将有沉淀生成,平衡后溶液中c(SO42-)等于3×10-3 mol/L
D.d点溶液通过蒸发可以变到c点
参考答案:B
本题解析:
本题难度:一般
2、填空题 某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A==H++HA-? HA- H++A2-?完成以下问题:
H++A2-?完成以下问题:
(1)Na2A溶液显______(填“酸性”“中性”或“碱性”),理由是________________(用离子方程式表示)。
(2)已知0.1 mol·L-1的NaHA溶液pH=2,则0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度_______0.11 mol·L-1(填“>”“=”或“<”)。
(3)锅炉水垢中的CaSO4,可用Na2CO3溶液处理,转化为CaCO3,而后用酸除去。过程中发生:CaSO4(1)+ CO32- CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K=?(计算结果保留三位有效数字)
CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K=?(计算结果保留三位有效数字)
参考答案:(1) 碱性? B2-+H2O  ?HA-+OH-? (2) < ?(3)1.75×10-4
?HA-+OH-? (2) < ?(3)1.75×10-4
本题解析:二元酸(化学式用H2A表示)在水中的电离方程式是:H2A==H++HA-? HA- H++A2- ,由此可以知道该该酸的第一步电离完全,而第二步电离不完全,为弱酸,故(1)Na2A溶液显碱性,理由是A离子的水解,其离子方程式为:B2-+H2O
H++A2- ,由此可以知道该该酸的第一步电离完全,而第二步电离不完全,为弱酸,故(1)Na2A溶液显碱性,理由是A离子的水解,其离子方程式为:B2-+H2O  ?HA-+OH-;(2)已知0.1 mol·L-1的NaHA溶液pH=2,即由 HA-电离的氢离子浓度为0.01mol/L,故H2A溶液中氢离子的物质的量浓度由于第一步的抑制而小于0.11 mol·L-1;(3)CaSO4(1)+ CO32-
?HA-+OH-;(2)已知0.1 mol·L-1的NaHA溶液pH=2,即由 HA-电离的氢离子浓度为0.01mol/L,故H2A溶液中氢离子的物质的量浓度由于第一步的抑制而小于0.11 mol·L-1;(3)CaSO4(1)+ CO32- CaCO3(1)+ SO42-的平衡常数
CaCO3(1)+ SO42-的平衡常数
K=c(SO42-)/c(CO32-)=Ksp[CaSO4]/Ksp[CaCO3]=4.90×10-5/=2.80×10-9=1.75×104。
点评:本题考查了盐的水解、溶度积,该题要理解二元酸在水中的电离方程式是:H2A==H++HA-
HA- H++A2- ,由此可以知道该该酸的第一步电离完全,而第二步电离不完全,本题难度中等。
H++A2- ,由此可以知道该该酸的第一步电离完全,而第二步电离不完全,本题难度中等。
本题难度:一般
3、填空题 在图(1)所示的装置中,烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入某种溶液(A)时,溶液的导电性的变化趋势如图(2)所示。
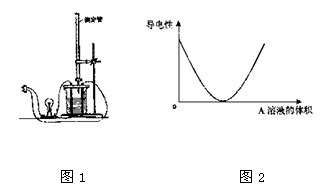
该根据离子反应的特点分析:A溶液中含有的溶质可能是_________或__________(至少写出两种),并写出相应的离子反应的离子方程式:
________________________________、____________________________
参考答案:H2SO4或CuSO4或MgSO4或(NH4)2SO4等。
离子方程式:2H++SO42—+Ba2++2OH—=BaSO4↓+2H2O
Mg2++SO42—+Ba2++2OH—=BaSO4↓+Mg(OH)2
本题解析:从图2可分析知,随着A的加入溶液导电能力迅速降低,说明A必定能与Ba(OH)2发生反应,使溶液中离子浓度变得极小,故不仅与Ba2+反应转化为沉淀,还要与OH—反应生成水或其它弱电解质,当反应完全后,过量A的加入,导电能力又显著上升,说明A应为强电解质,
本题难度:简单
4、选择题 已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出?AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系,如图是卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线,AgCl、AgBr、AgI的Ksp依次减小,下列说法错误的是

[? ]
A.A线是AgCl,C线是AgI?
B.e点表示由过量的KI与AgNO3反应产生AgI沉淀
C.d点是在水中加入足量的AgBr形成的饱和溶液
D.B线一定是AgBr
参考答案:B
本题解析:
本题难度:一般
5、选择题 25℃时,5种银盐的溶度积常数(Ksp)分别是:
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI
1.8×10-10
1.4×10-5
6.3×10-50
7.7×10-13
8.51×10-16
|
下列说法正确的是( )
A.氯化银、溴化银和碘化银的溶解度依次增大
B.将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不能得到黑色沉淀
C.在5mL1.8×10-5?mol/L的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3mol/L的AgNO3溶液,能观察到白色沉淀
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成
参考答案:A.氯化银、溴化银和碘化银的溶度积依次减少,结构相似,溶度积越小,溶解度越小,故A错误;
B.硫化银的溶度积比硫酸银小,将硫酸银溶解于水后,向其中加入少量硫化钠溶液,可得到黑色沉淀,故B错误;
C.c(Cl-)=1.8×10-5mol/L×55+0.05,c(Ag+)=1.0×10-3mol/L×0.055+0.05,
则c(Cl-)×c(Ag+)=1.8×10-5mol/L×55+0.05×1.0×10-3mol/L×0.055+0.05<1.8×10-10(mol/L)2,不能析出沉淀,故C错误;
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,如满足c(Cl-)×c(Ag+)>1.8×10-10,则可生成沉淀,故D正确.
故选D.
本题解析:
本题难度:一般