1、选择题 已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是
[? ]
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/LNH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
参考答案:B
本题解析:
本题难度:一般
2、填空题 (10分)据《辽沈晚报》报道,今年冬天,一旦出现大气严重污染的天气,沈阳市有可能建议政府机关、企事业单位根据实际情况实行员工休假或弹性工作制。大气含有的CO、氮氧化物、SO2、烟尘等污染是导致雾霾天气的原因之一,化学反应原理是减少和控制雾霾天气的理论依据。
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:___________________。
(3) 利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(5)已知在常温常压下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ?△H=" -556.0" kJ·mol-1
③ H2O(g)=H2O(l)?△H=" -44.0" kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
参考答案:(1) c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);(2)CO+4OH—-2e-=CO32-+2H2O;
(3) 2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;(4)5.6×10-5mol/L;
(5) CH3OH(L)+3/2O2(g)=CO2(g)+2H2O(l)ΔH=-725.8KJ/mol。
本题解析:(1)n(CO2)=" 0.4mol" ,n(NaOH)= 0.2L×3mol/L=0.6mol.假设反应后产物中含Na2CO3、NaHCO3 的物质的量分别是x、y,则根据C元素守恒可得x+y=0.4mol;根据Na元素守恒可得2x+y=0.6mol。解得x=y=0.2mol。所以溶液是Na2CO3、NaHCO3等物质的量浓度的混合溶液。根据物料守恒可知离子浓度最大的是c(Na+)。由于二者都要水解消耗水电离产生的H+,所以最终溶液中c(OH-)>c(H+),而CO32-水解的程度大于HCO3-的水解程度,所以c(HCO3-)>c(CO32-);但是盐的水解程度是微弱的,在溶液中主要还是以盐电离产生的离子存在,盐电离产生的离子浓度远大于弱电解质水的电离产生的离子,所以c(CO32-)>c(OH-)。溶液中离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,通入燃料的电极是负极,电极反应方程式为CO+4OH—-2e-=CO32-+2H2O;(3) 由于Fe2+、Fe3+对SO2的转化有催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;(4)假设生成沉淀所需CaCl2溶液的最小浓度为x,由于溶液等体积混合时各种物质的浓度都减小一半,所以 (x/2)×[(2×10—4mo1/L)÷2]≥2.8×10—9=5.6×10-5mol/L;(5)①+②÷2+③×2,整理可得:CH3OH(L)+3/2O2(g)=CO2(g)+2H2O(l)ΔH=-725.8KJ/mol。
考点:考查微粒浓度的比较、燃料电池电极反应式和离子方程式、热化学方程式的书写的知识。
本题难度:困难
3、填空题 FeS饱和溶液中存在溶解平衡:FeS(s) Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
⑴理论上FeS的溶解度为?。
⑵又知FeS饱和溶液中[H+]与[ S2-]之间存在着如下关系:[H+]2·[ S2-]=1.0×10-22 mol3/L3,为了使溶液里[Fe2+]达到了1mol/L,现将FeS适量投入到其饱和溶液中,应调节溶液中的[H+]为?。
参考答案:⑴7.92×10-8 g;⑵1.11×10-3mol/L。
本题解析:⑴由FeS(s) Fe2+(aq)+S2-(aq),[Fe2+]=
Fe2+(aq)+S2-(aq),[Fe2+]=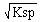 =
=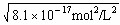 =9×
=9×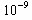 mol/L,即水中溶解的FeS的溶解度为S(FeS)=9×
mol/L,即水中溶解的FeS的溶解度为S(FeS)=9×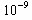 mol/L×88g/mol×
mol/L×88g/mol×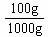 =7.92×10-8 g;⑵由[Fe2+]=1mol/L,则[ S2-]=
=7.92×10-8 g;⑵由[Fe2+]=1mol/L,则[ S2-]=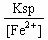 =
=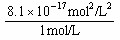 =8.1×10-17 mol/L,又由于[H+]2·[ S2-]=1.0×10-22 mol3/L3,所以[H+]=1.11×10-3mol/L。
=8.1×10-17 mol/L,又由于[H+]2·[ S2-]=1.0×10-22 mol3/L3,所以[H+]=1.11×10-3mol/L。
本题难度:一般
4、选择题 下列关于沉淀溶解平衡的说法中不正确的是( )
A.难溶电解质在溶液中存在沉淀溶解平衡,且是一种动态平衡
B.Ksp只与难溶电解质的性质与温度有关,而与沉淀的量和溶液中离子的浓度无关
C.Ksp反映了物质在水中的溶解能力,可直接根据Ksp的大小比较电解质在水中溶解能力的大小
D.可通过Q和Ksp的相对大小,来判断沉淀溶解平衡的移动方向
参考答案:A.难溶电解质在溶液中达到沉淀溶解平衡时生成沉淀的速率和沉淀溶解的速率相等,且不等于零,即沉淀溶解平衡是一种动态平衡,故A正确;
B.Ksp是温度的常数,只随温度改变而改变,不同物质的溶解能力不同,与物质本身的性质有关,故B正确;
C.不同类型的难溶物的溶解度大小,必须通过计算溶解度比较,不能通过溶度积直接比较,比较同类型的难溶物的溶解度大小,可通过溶度积直接比较溶解度大小;故C错误;
D.Q>Ksp为过饱和溶液会析出沉淀,Q=Ksp为饱和溶液,Q<Ksp为不饱和溶液,所以可通过Q和Ksp的相对大小,来判断沉淀溶解平衡的移动方向,故D正确;
故选C.
本题解析:
本题难度:一般
5、填空题 (8分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4? B. H2O2? ? C. 氯水? ? D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH? B. NH3·H2O? C. CuO? D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。? ( 提示:lg5 =0.7)
参考答案:(8分)?(1) B(1分)? CD(2分)?(2)4(2分)? 3.3 (2分)?可行(1分)
本题解析:略
本题难度:一般