1、选择题 下列说法正确的是:?
[? ]
A.在100?℃、101?kPa条件下,液态水的气化热为40.69?kJ·mol-1,则H2O(g) ?H2O(l)?的ΔH?=?40.69?kJ·mol-1
?H2O(l)?的ΔH?=?40.69?kJ·mol-1
B.已知MgCO3的Ksp?=?6.82?×?10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)?=?c(CO32-),且c(Mg2+)?·?c(CO32-)?=?6.82?×?10-6
C.已知: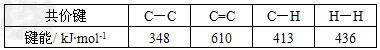 则可以计算出反应
则可以计算出反应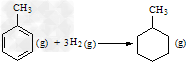 ?的ΔH为-384?kJ·mol-1
?的ΔH为-384?kJ·mol-1
D.常温下,在0.10?mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使NH3·H2O的电离度降低,溶液的pH减小
参考答案:D
本题解析:
本题难度:一般
2、选择题 25℃ CaCO3固体溶于水达饱和时物质的量浓度是9.327×10-5 mol/L,则CaCO3在该温度下的Ksp为(?)
A.9.3×10-5 mol/L
B.9.7×10-9 mol2/L2
C.7.6×10-17 mol4/L4
D.8.7×10-9 mol2/L2
参考答案:D
本题解析:CaCO3饱和溶液中[Ca2+]=[CO32-]=9.327×10-5 mol/L,Ksp=[Ca2+]·[CO32-]=9.327×10-5 mol/L×9.327×10-5 mol/L=8.7×10-9 mol2/L2。
本题难度:一般
3、选择题 Ag2S中混有少量AgCl,可以把该混合物加入以下哪种溶液中除去AgCl?(?)
A.盐酸
B.NaOH溶液
C.Na2S溶液
D.H2SO4溶液
参考答案:C
本题解析:AgCl的溶解度大于Ag2S,所以将混有ACl的.Ag2S放入到Na2S溶液中形成更难溶的Ag2S而除去。答案选C。
点评:溶剂度大的沉淀易转化成溶解度小的沉淀。
本题难度:简单
4、填空题 已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=1.5×10-10 ②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

请根据以下信息回答下旬问题:
(1)25℃时,将20mL 0.10 mol/L CH3COOH溶液和20mL 0.10 mol/LHSCN溶液分别与20mL 0.10 mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为下图所示:
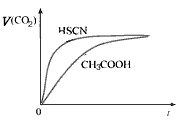
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是___________________ ,
②反应结束后所得两溶液中,c(CH3COO-)__________c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈__________________ ,列式并说明得出该常数的理由________________ 。
(3)4.0×10-3 mol/LHF溶液与4.0×10-4 mol/LCaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。_____________________________
参考答案:(1)①相同的起始条件,只能是因为两种酸的电离度不同导致溶液中起始反应时H+浓度不同引起反应速率的不同;②<。
(2)Ka=0.4×10-3;HF电离平衡常数Ka= c(H+)·c(F-)/ c(HF),其中c(H+)、 c(F-)、 c(HF)都是电离达到平衡时的浓度,选择中间段图像求解。根据图像:PH=4时,c(H+)=10-4, c(F-)=1.6×10-3、 c(HF)=4.0×10-4。
(3)PH=4.0,则c(H+)=10-4,此时:根据HF电离,产生的c(F-)=1.6×10-3,而溶液中的c(Ca2+)=2.0×10-4。c2(F-)×c(Ca2+)=5.12×10-10, 5.12×10-10大于Kap(CaF2)=1.5×10-10,此时有少量沉淀产生。
本题解析:
本题难度:一般
5、选择题 在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:
Ca(OH)2(s)  Ca2+(aq) + 20H-(aq),当向此悬浊液中加入少量氧化钙固体时,下列说法正确的是
Ca2+(aq) + 20H-(aq),当向此悬浊液中加入少量氧化钙固体时,下列说法正确的是
A.c(Ca2+)增大
B.c(Ca2+)不变
C.c(OH-)增大
D.Ca(OH)2固体的质量不变