1、选择题 草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.01 mol·L-1KHC2O4溶液中,下列关系正确的是?(?)
A.c (K+) + c (H+) =" c" (HC2O4-) + c (OH-) + c (C2O42-)
B.c (HC2O4-) + c (C2O42-) =" 0.01" mol·L-1
C.c (C2O42-) < c (H2C2O4)
D.c (K+) =" c" (H2C2O4) + c (HC2O4-) + c (C2O42-)
参考答案:D
本题解析:A不正确,不符号电荷守恒,应该是c (K+) + c (H+) =" c" (HC2O4-) + c (OH-) + 2c (C2O42-);B不正确,不符号物料守恒,应该是c (H2C2O4) +c (HC2O4-) + c (C2O42-) =" 0.01" mol·L-1。草酸氢钾溶液呈酸性,这说明电离出大于水解程度,则c (C2O42-)> c (H2C2O4),C不正确;D正确,符号物料守恒,答案选D。
点评:该题是中等难度的试题,试题贴近高考,综合性强。侧重对学生能力的培养,有利于调动学生的学习积极性。该题的关键是利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒,并能结合题意灵活运用即可。
本题难度:一般
2、填空题 常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示):?。
(2)混合溶液中由水电离出的c(OH-)?(填“>”、“<”或“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)=?mol·L-1,c(OH-)-c(HA)=?mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH?7(填“>”、“<”或“=”);将同温度下等浓度的四种盐溶液:
A.NH4HCO3?B.NH4A? C.(NH4)2SO4?D.NH4Cl
按pH由大到小的顺序排列是?(填序号)。
参考答案:(1)A-+H2O HA+OH-
HA+OH-
(2)>
(3)9.9×10-7 10-8
(4)> A>B>D>C
本题解析:(2)混合溶液由于A-水解,促进水的电离,而NaOH抑制水的电离。
(3)一开始c(Na+)=c(A-),但Na+不水解,A-水解,c(Na+)与c(A-)之差即为水解的A-的量。pH=8,c(H+)=10-8 mol·L-1,c(OH-)=10-6 mol·L-1。
由H2O电离的c(OH-)H2O=c(H+)=10-8 mol·L-1
A-+H2O HA+OH-
HA+OH-
则c(Na+)-c(A-)=c(OH-)-c(OH-)H2O=9.9×10-7 mol·L-1
c(OH-)-c(HA)=10-6 mol·L-1-9.9×10-7 mol·L-1=10-8 mol·L-1
(4)NH4A溶液为中性,说明NH4+与A-的水解程度相当,而HA加到Na2CO3中有气体放出,说明HA酸性强于H2CO3,CO32-水解程度大于A-,因而(NH4)2CO3溶液pH>7,NH4HCO3溶液的pH也同样大于7。Cl-和SO42-不水解,所以(NH4)2SO4和NH4Cl溶液显酸性,但(NH4)2SO4中NH4+更多,水解程度更大,因而pH[(NH4)2SO4]<pH(NH4Cl)<7=pH(NH4A)<pH(NH4HCO3)。
本题难度:一般
3、选择题 为配置NH4+的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入
[? ]
① 适量HCl ② 适量NaCl ③ 适量氨水 ④ 适量NaOH
A.①②
B.③
C.③④
D.④
参考答案:B
本题解析:
本题难度:一般
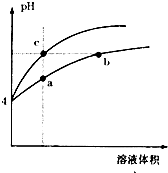
4、选择题 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的PH变化曲线如图所示,下列判断正确的是( )
A.a、c两点溶液的导电能力相同
B.b点溶液中c(H+)+c(NH3?H2O)=c(OH-)
C.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb=V
D.a、b、c三点溶液水的电离程度a>b>c